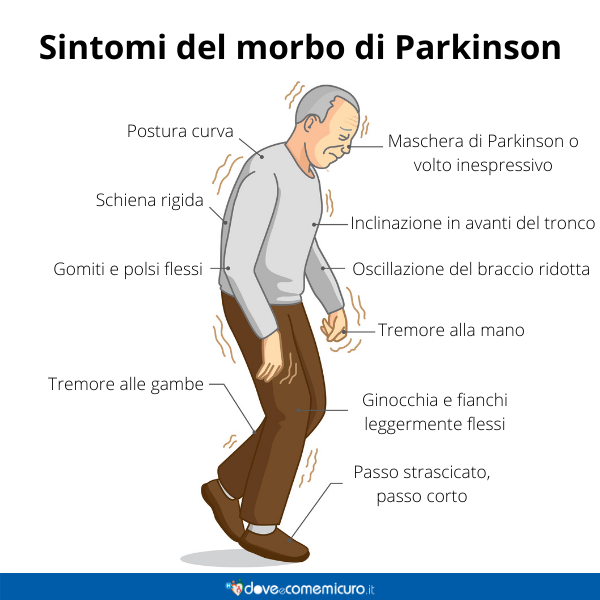
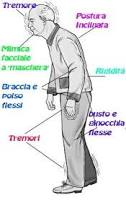
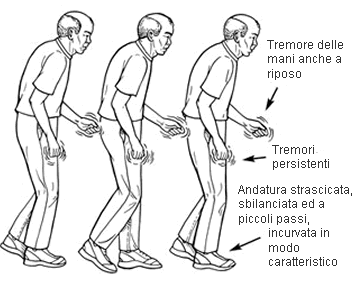
Miglioramento drammatico dei sintomi parkinsoniani dopo l’introduzione di una dieta priva di glutine in un paziente con malattia celiaca silente
Vincenzo Di Lazzaro et al. J Neurol . 2014 febbraio
Anticorpi correlati alla celiachia nei pazienti con malattia di Parkinson: uno studio caso-controllo.
GUL. Sabaz, BOB. Barut, SDT. Tekol (Istanbul, Turchia)
Incontro: Congresso virtuale MDS 2021
malattia autoimmune causata da cibi con glutine fin dall’infanzia, il glutine distrugge con meccanismo autoimmune alcune cellule del sistema nervoso centrale, inoltre il glutine causa infiammazione intestinale difese immunitarie alterate, ipo funzione tiroidea, diabete con infezioni sistemiche nel sangue, batteri vanno al cervello contribuendo al peggioramento dei sintomi, cellule nervose cerebrali compiono movimenti involontari per edfetti di queste infezioni batteriche !
Infezione e rischio di malattia di Parkinson
Richard J. Smeyne, Alastair J. Noyce, […] e Connie Marras
Ulteriori informazioni sull’articolo
Astratto
Si ritiene che il morbo di Parkinson (PD) sia causato da una combinazione di fattori genetici e ambientali. L’infezione batterica o virale è stata proposta come potenziale fattore di rischio e vi sono prove epidemiologiche e scientifiche di base a sostegno, sebbene non del tutto coerenti, a sostegno del suo ruolo. L’encefalite causata dall’influenza ha incluso caratteristiche parkinsoniane. L’evidenza epidemiologica è più convincente per un’associazione tra PD e virus dell’epatite C. Infezione da Helicobacter pyloripuò essere associato non solo al rischio di PD, ma anche alla risposta alla levodopa. La rapida evoluzione delle conoscenze sul ruolo del microbioma suggerisce anche un ruolo dei batteri residenti nel rischio di PD. La plausibilità biologica per il ruolo degli agenti infettivi è supportata dai noti effetti neurotropici di virus specifici, dalla particolare vulnerabilità della substantia nigra e persino dalla promozione dell’aggregazione dell’alfa-sinucleina. Una caratteristica comune dei virus implicati sembra essere la produzione di alti livelli di citochine e chemochine che possono attraversare la barriera emato-encefalica portando all’attivazione e all’infiammazione della microglia e, infine, alla morte delle cellule neuronali. Sulla base di molteplici vie di evidenza, sembra probabile che specifiche infezioni batteriche e in particolare virali possano aumentare la vulnerabilità al morbo di Parkinson.Parole chiave: morbo di Parkinson, infezione, virus, batteri, eziologia
EZIOLOGIA DELLA MALATTIA DI PARKINSON: CONCETTI ATTUALI
Numerosi fattori genetici e ambientali sono stati associati alla malattia di Parkinson (PD), che si pensa sia causata da una complessa interazione di molteplici fattori unici per un individuo. Nell’ultimo decennio, il numero di fattori di rischio genetici noti è notevolmente aumentato con 90 alleli di rischio ora identificati [ 1 ]. Tuttavia, questi loci noti rappresentano solo circa il 20% del rischio di PD [ 1 ], lasciando una percentuale sostanziale di PD non spiegata sulla base delle associazioni genetiche attualmente note. È urgente identificare la frazione eziologica mancante, per sviluppare strategie preventive e terapeutiche.
Esistono prove coerenti o per lo più coerenti per diverse associazioni ambientali con rischio di PD (p. es., associazioni inverse con fumo di sigaretta, assunzione di caffeina, attività fisica, urato plasmatico e associazioni positive con esposizione a pesticidi) [ 2 ] e un gran numero di associazioni con meno prove coerenti che abbracciano più categorie, inclusi fattori dietetici, esposizioni chimiche, traumi fisici ed emotivi [ 3]. Una delle categorie più controverse di fattori di rischio è l’infezione, batterica o virale.
INFEZIONE E PD: UNA PROSPETTIVA EPIDEMIOLOGICA
La possibilità di un fattore scatenante infettivo o di un contributo al PD ha ottenuto il sostegno di diverse strade. Le prime osservazioni di gruppi di individui affetti da parkinsonismo in seguito a focolai infettivi forniscono un esempio di presunte infezioni virali seguite e quindi ritenute portatrici di malattie neurologiche croniche che causano parkinsonismo. Un esempio di ciò, riconoscendo che la malattia è patologicamente distinta dal PD, è l’encefalite letargica e il successivo parkinsonismo postencefalitico che è stato associato alla pandemia influenzale del 1918 [ 4 ]. Inoltre sono stati segnalati altri casi di parkinsonismo postencefalitico a seguito di infezioni non influenzali, sebbene questi siano stati rari [ 5, 6]. Più recentemente, il ruolo dell’infezione ha acquisito plausibilità attraverso l’ipotesi di Braak di una diffusione patologica a partire dal bulbo olfattivo e dai nervi periferici del tratto gastrointestinale [ 7 ]. Entrambe queste posizioni potrebbero essere portali di ingresso per un fattore scatenante ambientale, tossico o infettivo. Costipazione e compromissione olfattiva sono due delle caratteristiche più comuni e precoci della fase prodromica del PD, a ulteriore sostegno dell’importanza della via olfattiva e del tratto gastrointestinale nella sua patogenesi [ 8 ]. Dal punto di vista patologico, l’infiammazione sembra essere una caratteristica precoce [ 9] che può essere coerente con il ruolo di un agente infettivo. Tuttavia, ci sono spiegazioni alternative per l’infiammazione come componente della patologia del PD e si discute se questa sia o meno una causa o una conseguenza del processo neurodegenerativo.
Ulteriori prove del ruolo di un fattore scatenante infettivo o di un fattore di rischio per PD si trovano in studi che mostrano una relazione tra esposizioni professionali specifiche e PD. In alcuni studi, le occupazioni in cui vi è una maggiore esposizione interpersonale (p. es., insegnamento, clero) mostrano un rischio maggiore di sviluppare PD [ 10]. C’è anche un corpus significativo di letteratura su infezioni specifiche e conseguente rischio di PD, che sarà discusso più avanti in questo articolo. Tuttavia, ci sono sfide significative nell’interpretazione dell’evidenza epidemiologica per l’eziologia nel PD. Il periodo prodromico molto lungo, che copre decenni, rende difficile la misurazione dei fattori scatenanti a causa dell’inadeguata disponibilità di registrazioni o dello scarso ricordo. Inoltre, esiste indubbiamente una complessa interazione di fattori genetici e ambientali influenzati dal processo neurodegenerativo durante il periodo prodromico che rende difficile l’interpretazione. Queste sfide generali sono amplificate dalla complessità di considerare i tempi e l’impatto relativo di esposizioni infettive multiple brevi nel corso della vita, i tipi ampiamente variabili di agenti infettivi, gravità variabile delle infezioni e inevitabile presenza di infezioni non riconosciute. Ad esempio, un recente studio epidemiologico ha testato l’ipotesi del “microbo multiplo” e ha riportato che il rischio di PD era aumentato rispetto ai controlli sani in individui sieropositivi per cinque o sei dei patogeni studiati (CMV, EBV, HSV-1,B. burgdorferi, C. pneumoniae e H. pylori) ma non meno [ 11 ].
Il ruolo delle infezioni nel PD può estendersi oltre l’essere un evento scatenante. Il PD è in definitiva una malattia dell’invecchiamento e il sistema nervoso che invecchia è vulnerabile agli effetti diretti e indiretti delle infezioni che possono influenzare le manifestazioni del PD. L’aumento dello stress ossidativo correlato all’età e la ridotta produzione di energia possono rendere i neuroni vulnerabili alla tossicità degli agenti infettivi [ 12]. È ben descritto che i sintomi del PD e di altre malattie neurodegenerative peggiorano nel contesto dell’infezione e di qualsiasi stress metabolico [ 13 ]. Come spesso osservato nella pratica clinica, questo peggioramento può durare mesi e potrebbe non tornare mai al valore basale.
Infezioni virali e rischio di PD
La nozione di un’eziologia virale del PD è stata discussa per molti anni. Un primo esempio, e oggi toccante alla luce della recente pandemia di SARS-CoV-2, è stato l’emergere di un disturbo parkinsoniano, l’encefalite letargica [ 14 ], che è stato collegato (sebbene non definitivamente collegato in modo causale) all’influenza del 1918 pandemia. I virus, in particolare quelli neurotropici, sono agenti causali plausibili del PD ma sono stati relativamente poco studiati rispetto ai fattori di rischio genetici e ad altri fattori di rischio ambientali per il PD. In questa sezione considereremo i virus che sono stati collegati al PD in studi osservazionali e valuteremo la forza dell’evidenza a sostegno di un nesso causale.
Il virus più comune associato al parkinsonismo è l’influenza. Ciascun ceppo del virus dell’influenza varia nella sua capacità di infettare direttamente il SNC. Quelli che possono infettare direttamente le cellule del sistema nervoso sono considerati neurotropici mentre quelli che non possono essere considerati non neurotropi. La maggior parte dei virus dell’influenza che sono circolati tra gli esseri umani non sono neurotropici; compreso il virus H1N1 del 1918 (influenza spagnola) [ 15 ], l’H2N2 del 1957-1958 (influenza asiatica) [ 16 ], l’H3N2 del 1968 (influenza di Hong Kong) [ 17 ] e l’H1N1 del 2009 (influenza suina o messicana) [ 18]. Nonostante la mancanza di infezione diretta del SNC, ciascuno di questi focolai pandemici è stato associato a encefalite con caratteristiche parkinsoniane. La caratteristica comune di ciascuna di queste influenze era la loro capacità di indurre una significativa infezione sistemica caratterizzata dalla produzione di livelli significativamente elevati di citochine e chemochine [ 4 ]. L’enorme volume di questa produzione di citochine/chemochine travolge la capacità del corpo di regolarle portando all’induzione di quella che è nota come una “tempesta di citochine” [ 19]. Un corpo di letteratura ha dimostrato che queste citochine periferiche possono passare attraverso la barriera ematoencefalica e comunicare con il cervello. In effetti, le citochine infiammatorie, come TGFalpha, IFNg e IL6, che sono sovraregolate dall’infezione influenzale possono indurre l’attivazione della microglia innescando una cascata infiammatoria nel cervello che può portare a disfunzioni neuronali e persino alla morte cellulare [ 20 ].
Un’ipotesi che è stata proposta sulla base di questi risultati è che l’infiammazione a base virale innesca il SNC; rendendola così più suscettibile a un successivo insulto che altrimenti sarebbe stato innocuo [ 21 ]. Questa è spesso la spiegazione usata per collegare l’influenza spagnola del 1918 allo sviluppo del parkinsonismo postencefalitico [ 14 ]. Oltre ai segni di parkinsonismo, l’encefalopatia (o encefalite letargica) di Von Economo includeva anche altri sintomi neurologici come ipersonnolenza e neuropatie craniche [ 22]. L’aspetto di questa sindrome associata all’influenza sembra essere abbastanza specifico per il ceppo influenzale H1N1 del 1918, sulla base della mancanza di un’associazione significativa tra infezione influenzale e PD in una meta-analisi che combina i dati di 4 piccoli studi caso-controllo (combinati OR 1,95, IC 95% 0,77–4,94 per il rischio di PD a seguito di infezione influenzale) [ 23]. Ciò suggerisce che non tutti i virus hanno lo stesso potenziale di danno al SNC e per quei virus non neurotropici sarà fondamentale comprendere il profilo della risposta infiammatoria indotta da ogni singolo virus. Ciò è particolarmente preoccupante a causa della recente epidemia di COVID-19, il cui agente causale è il coronavirus SARS-CoV2. Gli studi preliminari sono dubbi sul potenziale neurotropico di questo virus. Tuttavia, ciò che è chiaro è che induce una significativa “tempesta di citochine”, con il potenziale per indurre una reazione infiammatoria nel cervello [ 24 ] e sensibilizzarlo a insulti successivi; anche nelle regioni note per essere colpite dal PD.
Anche i virus dell’epatite B e C sono stati studiati per le loro associazioni con il morbo di Parkinson in recenti studi epidemiologici. La comprensione di tali associazioni è importante data la prevalenza di queste infezioni. Il virus dell’epatite C (HCV) è un virus a RNA della famiglia dei Flavivirus e si stima che infetti 143 milioni di persone in tutto il mondo. Coinvolge principalmente il fegato con infezione cronica che porta a cirrosi e carcinoma epatocellulare [ 25 ]. Le manifestazioni extraepatiche includono una miriade di disturbi infiammatori e immuno-mediati [ 26-28 ].
Uno studio osservazionale di Taiwan, in un ambiente comunitario, ha mostrato che la diagnosi precedente di HCV era associata a un aumento del rischio di PD successivo (odds ratio (OR) 1,39, IC 95% 1,07–1,80), ma non è stata osservata alcuna associazione simile con HBV [ 28 ]. È seguito uno studio prospettico più ampio su circa 0,25 milioni di persone dal database di ricerca sull’assicurazione sanitaria nazionale di Taiwan che sembrava confermare queste osservazioni. Ha mostrato che la diagnosi precedente con HCV era associata a un aumentato rischio di PD (HR aggiustato 1,29, IC 95% 1,06–1,56). Anche in questo caso, una precedente infezione da epatite B (HBV) non era associata a un simile aumento del rischio [ 29]. Nonostante la coerenza di questi risultati, una limitazione è che avevano periodi di studio sovrapposti, potrebbero aver incluso alcuni degli stessi partecipanti e che la definizione clinica di PD era basata solo su codici diagnostici senza alcuna conferma clinica. In uno studio separato con sede nel Regno Unito, Pakpoor e colleghi hanno utilizzato il database Hospital Episode Statistics (HES) per valutare ulteriormente questa associazione. Hanno riportato associazioni sia per HCV (RR 1,51 (IC 95%, 1,18–1,9)) che per HBV (RR 1,76 (IC 95% 1,28–2,37) utilizzando rapporti di frequenza standardizzati [ 30 ], ma non c’era una chiara associazione con altre cause di epatite Una revisione sistematica e una meta-analisi hanno calcolato un OR combinato di 1,35 (IC 95% 1,18–1,93) per l’infezione da HCV [ 31], e una successiva meta-analisi che includeva altri due studi ha dato un OR di 1,19 (IC 95% 1,01–1,41) [ 23 ]. Infine, il più recente studio osservazionale (da Israele) ha ulteriormente esplorato la relazione, riportando un OR di 1,18 (IC 95% 1,04–1,35) per HCV e OR 1,08 (IC 95% 1,00–1,16) per HBV [ 32 ]. Pertanto, l’evidenza epidemiologica attualmente disponibile suggerirebbe un’associazione positiva, sebbene piccola, tra HCV e sviluppo futuro del PD. L’evidenza diretta a sostegno di un’associazione tra epatite e PD deriva da studi che dimostrano che l’HCV è neurotropico; e una volta nel cervello, il tipo di cellula predominante che ospita l’infezione da HCV sono i macrofagi/microglia [ 27 ]. Inoltre, in vitrostudi che esaminano gli effetti dell’infezione da HCV nel cervello di ratto in coltura hanno dimostrato che questo agente può indurre la perdita di neuroni dopaminergici [ 26, 28 ].
Se esiste una relazione causale tra HCV e PD, ci si aspetterebbe che un trattamento efficace dell’infezione da HCV possa mitigare il rischio. Due studi recenti, sempre utilizzando il database dell’assicurazione sanitaria nazionale taiwanese, hanno esplorato il ruolo della terapia con interferone per l’infezione cronica da HCV per vedere se questo fosse associato a un minor rischio di PD [ 33, 34]. Data la probabilità di una notevole sovrapposizione in questi studi a causa di periodi di studio quasi identici e potenzialmente dell’inclusione degli stessi pazienti, i risultati forse non sono stati sorprendentemente simili. Nel primo studio, i ricercatori hanno selezionato circa 0,25 milioni di pazienti con infezione da HCV registrata e li hanno divisi in quelli che sono stati trattati con interferone (più ribavirina) e quelli che non sono stati trattati. Nel gruppo trattato, il rischio di PD era inferiore rispetto al gruppo non trattato (HR aggiustato 0,75, IC 95% 0,59–0,96 dopo 5 anni di follow-up), suggerendo che l’aumento del rischio associato all’infezione da HCV può essere mitigato da trattamento antivirale. Nel secondo studio, l’infezione da HCV è stata nuovamente associata al parkinsonismo; il trattamento con antivirali è stato associato a una riduzione del rischio del 38% (HR aggiustato 0,62; IC 95% 0,50–0,77) [ 34]. Gli autori hanno proposto che il trattamento antivirale riduca la neuroinfiammazione, riducendo così il rischio.
Il virus dell’immunodeficienza umana (HIV) viene acquisito in modo simile all’HCV e le infezioni con i due si verificano frequentemente. L’infezione da HIV colpisce circa 37 milioni di persone in tutto il mondo ed è associata a un ampio spettro di disturbi neurologici, da immunodeficienza che porta a infezioni opportunistiche, malignità o condizioni infiammatorie, o conseguenze neurologiche dirette dell’HIV, compresi i disturbi neurocognitivi associati all’HIV (MANO). Nonostante la prevalenza di HIV e PD, ci sono esempi limitati di studi osservazionali di alta qualità che esplorano un legame tra di loro. Questo nonostante il parkinsonismo (e altri disturbi del movimento) sia ben riconosciuto nei pazienti con infezione cronica da HIV e MANO [ 35, 36]. La manifestazione del parkinsonismo insieme al deterioramento cognitivo può essere vista nel contesto dell’encefalopatia da HIV o della demenza associata all’HIV, ma ci sono segnalazioni di pazienti affetti da HIV con parkinsonismo isolato e fino al 5-10% dei pazienti affetti da HIV può avere deficit motori simili al PD [ 37 , 38 ]. Alcuni dei primi casi/serie suggerivano che il parkinsonismo potesse essere smascherato nei pazienti affetti da HIV trattati con antipsicotici o anche con terapia antiretrovirale altamente attiva (HAART) [ 36, 37]. Tuttavia, in generale, la prevalenza di HAND è diminuita nell’era HAART [ 39]. Un recente studio osservazionale su larga scala ha suggerito una protezione relativa contro PD incidente nei pazienti HIV trattati con farmaci antiretrovirali rispetto a quelli che non lo erano (HR per danno neurocognitivo 0,41, 0,37–0,45) [ 40 ]. Nel suddetto studio di Pakpoor e colleghi [ 30 ] che utilizzava dati HES nel Regno Unito, l’HIV non era associato a PD incidente (RR 0,98; IC 95% 0,50–1,70). Una piccola, incontrollata revisione retrospettiva delle cartelle cliniche dei pazienti affetti da HIV in Brasile ha suggerito che l’incidente PD non era più frequente che nella popolazione generale [ 41 ]. L’HIV non è apparso in una recente revisione sistematica e meta-analisi delle infezioni e del rischio di PD [ 23], e non siamo a conoscenza di altri studi caso-controllo o di coorte che valutino il collegamento. Pertanto, le prove fino ad oggi sono contrastanti e sono necessarie ulteriori ricerche per comprendere la relazione.
Oltre alle associazioni già descritte, esistono altri esempi di parkinsonismo che si manifestano durante infezioni virali acute tra cui l’infezione da virus Coxsakie (un picornavirus) e più classicamente in pazienti affetti da Flavivirus come l’encefalite giapponese, l’encefalite di St Louis, il virus dell’encefalite equina occidentale (WEEV) e il virus del Nilo occidentale [ 22 ]. Per questi ultimi esempi, la predilezione per il coinvolgimento dei gangli della base è evidente, ma il parkinsonismo si manifesta spesso insieme a uno spettro più ampio di segni e sintomi neurologici, piuttosto che in isolamento e non è chiaro come il parkinsonismo descritto in questi rapporti possa essere correlato al PD con patologia di Lewy .
Uno dei maggiori ostacoli a trarre conclusioni sul legame tra infezioni virali e PD è la grave mancanza di studi epidemiologici di alta qualità. La maggior parte dei dati proviene da piccoli studi caso-controllo, con i pregiudizi inerenti alla progettazione e alla probabilità di essere pubblicati. Mancano studi di coorte di alta qualità e vi sono difficoltà in merito all’accertamento dell’esposizione, alla latenza, alla durata, nonché a fattori confondenti come la vaccinazione, il trattamento e la coinfezione per molte delle infezioni virali croniche.
Infezioni batteriche e rischio di PD
L’ampio spettro di batteri che possono infettare in modo acuto o permanente i tessuti dell’uomo è stato associato allo sviluppo e, in misura minore, alla progressione del PD. La produzione batterica di fattori pro-infiammatori e neurotossici potrebbe svolgere un ruolo importante nello sviluppo e/o nella cascata di eventi neurotossici che portano alla degenerazione. Un attore chiave in tali eventi è l’endotossina lipopolisaccaride batterica (LPS). LPS stimola la produzione di diversi fattori infiammatori che possono contribuire alla neurodegenerazione. Il fattore di necrosi tumorale-α (TNF-α) viene rilasciato dalla microglia; l’ossido nitrico (NO) viene rilasciato dalla microglia e dagli astrociti e vi è iperproduzione di prostagladine. Tutti questi fenomeni possono portare a neurodegenerazione e gliosi [ 42]. Dato che LPS è l’endotossina dei batteri Gram-negativi, in teoria, ogni infezione Gram-negativa può indurre una cascata che potrebbe innescare PD; tuttavia, le prove sui batteri sono limitate a un numero di organismi specifici.
Borrelia Budgdoferi è una spirocheta Gram-negativa che è l’unica causa nota della malattia di Lyme in Nord America. L’infezione da Borrelia Budgdoferi può interessare il sistema nervoso centrale e, quando attiva, può causare una sindrome che può assomigliare al PD [ 43 ]. In effetti, ci sono alcune prove iniziali che la malattia di Lyme può influenzare l’attività dopaminergica, in particolare la componente dopaminergica del meccanismo di ricompensa frontale [ 44 ]. Aneddoticamente, è stato riportato che l’infezione da B. burgdorferi può danneggiare la substantia nigra [ 45]. Tuttavia, l’evidenza epidemiologica non supporta un legame tra malattia di Lyme e PD; quando sono state confrontate le posizioni geografiche della malattia di Lyme e la morte per PD, non è stata trovata alcuna correlazione. Data la distribuzione focale della malattia di Lyme negli Stati Uniti (Midwest, Northeast e Mid-Atlantic) ci si aspettava un aumento del PD in quelle regioni se ci fosse una correlazione positiva, ma non è stata suggerita alcuna associazione [ 46 ]. Inoltre, uno studio che ha utilizzato il registro nazionale danese dal 1986 al 2016 per identificare 2.607 casi di neuroborreliosi di Lyme non ha riscontrato un rischio a lungo termine significativamente aumentato di PD e altre malattie neurodegenerative [ 47 ].
L’Helicobacter pylori è un batterio Gram-negativo che infetta gran parte della popolazione mondiale causando principalmente sintomi gastrointestinali. L’associazione con PD è stata ampiamente esplorata [ 48 ]. L’aumento delle ulcere gastriche e duodenali nei pazienti con PD è stato descritto già negli anni ’60 [ 49 ]. Prima dell’avvento del trattamento antibiotico dell’infezione da H. pylori , il trattamento classico dell’infezione da H. pylori era la vagotomia che, in modo interessante, è stata associata a una riduzione del rischio di PD [ 50 ]. Un’ampia meta-analisi ha riportato un rischio aumentato di 1,5-2 volte di sviluppare PD dopo l’infezione da H. pylori ; [ 51] e ampi studi caso-controllo hanno riportato un aumento di 2-3 volte della PD nei pazienti con H. pylori [ 52 ]. Pertanto, l’associazione tra PD e H. pylori è confermata sebbene non sia stata dimostrata una relazione causale. Essendo un agente patogeno gastrointestinale, un ruolo causale è biologicamente plausibile attraverso un “portale di ingresso” gastrointestinale secondo l'”ipotesi del doppio colpo” [ 7 ]. D’altra parte, l’eradicazione dell’H. pylori non sembra alterare il rischio di PD. [ 52 ] Inoltre, H. pylori ha un ruolo critico nell’assorbimento della L-dopa e, quindi, nei trattamenti sintomatici. L’eradicazione dell’infezione può essere importante per migliorare la risposta alla L-Dopa [53 ] e, al contrario, una riduzione della risposta alla L-Dopa richiede la considerazione della presenza di H. pylori [ 54 ].
La potenziale associazione tra PD e infezione batterica non è limitata ai microrganismi Gram-negativi. Nocardia asteroides , un batterio Gram-positivo debole, è stato segnalato per indurre potenzialmente patologia simil-PD nei topi [ 55 ]. Un altro studio ha riportato la possibile induzione di apoptosi nella substantia nigra [ 56 ] suggerendo una vulnerabilità dei neuroni dopaminergici agli effetti dell’infezione da Nocardia. D’altra parte, uno studio caso-controllo sul siero di pazienti con PD non ha riportato un’associazione significativa tra Nocardia asteroidi e PD [ 57 ].
È importante considerare il possibile ruolo di più agenti patogeni insieme; infatti, quando più batteri stanno colonizzando e/o agiscono in sinergia, potrebbe esserci un aumento e un rischio cumulativo di malattie, come dimostrato nell’ictus [ 58 ] e nel morbo di Alzheimer [ 59 ]. Uno studio ha esplorato il ruolo del carico infettivo nel PD, esplorando la presenza di anticorpi contro il citomegalovirus, il virus di Epstein Barr, il virus dell’herpes simplex di tipo-1, Borrelia burgdorferi, Chlamydophila pneumoniae e Helicobacter pylori nel siero di pazienti con PD e controlli [ 11 ]]. Lo studio ha osservato che la combinazione dei precedenti batteri e virus era associata al PD rispetto ai controlli; tuttavia, un ruolo causale non è stato chiarito e sono necessari ulteriori studi.
In particolare, ci sono prove minime di associazioni tra infezioni più gravi come la sepsi e il rischio futuro di PD. Uno studio caso-controllo pubblicato di recente ha riportato che non vi era alcuna associazione tra infezioni gravi che richiedevano ricovero in ospedale e sepsi e il rischio di PD più tardi nella vita [ 60 ]. Tuttavia, non è ancora chiaro se una condizione infettiva prossima all’inizio del PD o prima dell’inizio del PD possa innescare o abbassare la soglia per il prossimo processo neurodegenerativo.
La comprensione del microbioma intestinale e del suo ruolo nel PD in particolare è un’area di studio attivo. L’interesse per il ruolo dei batteri intestinali è stato fortemente promosso da prove patologiche per il coinvolgimento dell’intestino all’inizio del PD. In effetti, un numero crescente di prove suggerisce che il PD possa iniziare nell’intestino o, almeno, che l’intestino possa costituire un portale di ingresso nel sistema nervoso che successivamente si diffonde al cervello [ 7 ]. Infatti, il tratto gastrointestinale può avere un ruolo nello sviluppo di sinucleinopatie mediate dall’attività batterica del microbioma intestinale. Le endotossine (LPS) prodotte da alcuni batteri intestinali (es. E. coli) sono stati segnalati per avere un ruolo nell’aggregare la sinucleina e generare prodotti tossici di sinucleina che possono partecipare alla cascata di eventi del PD [ 61-63 ]. Il tratto gastrointestinale contiene circa 1.000 diverse specie batteriche e numerosi studi hanno mostrato differenze nel microbioma intestinale tra individui con e senza PD [ 64 ]. I potenziali meccanismi stanno cominciando a essere chiariti; uno studio iniziale su topi che sovraesprimono la sinucleina ha evidenziato che il microbiota estratto da pazienti con PD causava sintomi motori e una cascata neuro-infiammatoria [ 65 ]. Sebbene gli studi condotti sull’uomo abbiano fornito risultati controversi [ 66], vi è una crescente evidenza che il microbiota nei pazienti con PD possa avere un ruolo significativo nello sviluppo della malattia. Uno studio recente ha riportato che c’era un’alterazione disbiotica dei batteri microbiotici nel PD nelle famiglie di Bifidobacteriaceae , Christensenellaceae , Lachno-spiraceae , Lactobacillaceae , Pasteurellaceae e Verrucomicrobiaceae [ 67]. Lo studio fornisce un possibile meccanismo per un effetto indiretto dei cambiamenti nel microbiota, dato che questa modifica provocherebbe un aumento dell’accumulo di pesticidi e altri xenobiotici che non vengono metabolizzati dal microbioma PD modificato; pertanto, l’accumulo di tali molecole può portare ad un aumento del rischio di PD. Sono necessari ulteriori studi per comprendere la relazione del microbioma intestinale con il PD perché il microbioma rappresenta un fattore di rischio potenzialmente modificabile non solo per la malattia incidente ma anche per la progressione della malattia.
È importante sottolineare che diversi studi hanno riportato una possibile riduzione del rischio di PD nei pazienti con appendicectomia [ 68-70 ]. Inoltre, la regolazione e il mantenimento della flora intestinale sembra essere mediata dall’appendice vermiforme, che non è più considerata un residuo vestigiale [ 60 ]. È infatti possibile ipotizzare che l’appendice possa essere non solo un serbatoio di sinucleina ma anche che la mancanza di regolazione della flora intestinale mediata dall’appendice potrebbe essere un altro componente per aumentare il rischio di PD.
Nel complesso, nonostante la crescente evidenza di un ruolo dei batteri nello sviluppo del PD (in particolare H. pylori e il microbioma intestinale), sono necessari ulteriori studi per comprendere il loro ruolo causale e le potenziali opportunità di trattamento.
MECCANISMI MOLECOLARI E EVIDENZE SCIENTIFICHE DI BASE PER IL RUOLO DELL’INFEZIONE NEL PD
Gran parte delle prove che associano il morbo di Parkinson alle infezioni, siano esse virali o batteriche, si basano su studi osservazionali che dimostrano un aumento del rischio di sviluppare la malattia, piuttosto che sull’evidenza diretta dell’infezione come causa singola. Infatti, a causa della complessità e dell’eziologia multifattoriale del PD, è spesso impossibile identificare un singolo punto di inizio nel PD umano (anche nei casi di mutazioni genetiche note). Per questo motivo, e per l’impossibilità di studi interventistici nell’uomo che coinvolgono agenti infettivi, l’uso di modelli animali preclinici di PD può fornire la prova più chiara a favore o contro un ruolo degli agenti infettivi nell’eziologia del PD.
Come discusso in precedenza in questa recensione, un certo numero di agenti virali sono stati collegati al PD, inclusi influenza, Coxsackie, encefalite B giapponese, WEEV, Herpesvirus, HCV e HIV [ 22, 71]. Il lavoro preclinico che esamina gli effetti di questi virus ha mostrato un supporto significativo per il loro ruolo nell’eziologia del PD, sebbene in molti casi non sia noto se gli effetti di queste infezioni virali siano diretti o indiretti. Quando i virus invadono il sistema nervoso, si dice che siano neurotropici. La cosa interessante di questi virus neurotropici è che invece di causare un’infezione generalizzata, spesso prendono di mira specifiche regioni del sistema nervoso. A causa di questa specificità, sindromi specifiche possono spesso essere attribuite a specifiche infezioni virali. Nel caso del PD, è stato dimostrato che il WEEV e alcuni ceppi di influenza neurotropica (p. es., H5N1) infettano direttamente le regioni colpite dal PD, incluso il sistema nervoso enterico, nonché le regioni del SNC, tra cui la substantia nigra e il bulbo olfattivo [ 72–74]. Oltre all’infezione diretta dei neuroni, questi virus sono anche gliotropici, portando a un’induzione sia dell’astrogliosi che della microgliosi [ 72, 74, 75 ]. Ciò che rende particolarmente interessanti sia i virus dell’influenza che il WEEV è che inducono anche una serie di cambiamenti nel cervello che sono importanti nel PD, tra cui l’induzione di un aumento dell’espressione dell’alfa-sinucleina fosforilata, la sottoregolazione della produzione di dopamina e la morte dei neuroni dopaminergici nel substantia nigra pars compacta [ 72–74]. L’induzione di queste specifiche patologie parkinsoniche sembra essere specifica dell’infezione virale. Ad esempio, utilizzando cellule dopaminergiche mesencefaliche umane di Lund, è stato riscontrato che l’infezione da H1N1 porta a un accumulo di alfa-sinucle-in secondario al blocco della funzione autofagosoma e alla proteostasi cellulare compromessa [ 76 ]. Ciò che è stato ancora più interessante è che questo processo non ha influenzato altre proteine (tau, TDP-43) note per aggregarsi nelle malattie neurodegenerative, dimostrando che ogni virus ha il potenziale per produrre proteinopatie specifiche, oltre ad agire come infiammatorio generale.
Come descritto sopra, molte infezioni non neurotropiche (sia virali che batteriche) inducono una risposta infiammatoria significativa in tutto il corpo, spesso indicata come risposta innata. Durante questa risposta innata, le cellule immunitarie circolanti secernono una serie di diverse proteine tra cui interferoni, interleuchine, chemochine, fattori stimolanti le colonie e TNF [ 77 ]. Ciò che è importante riconoscere è che all’interno di queste classi di molecole infiammatorie, alcune sono considerate pro-infiammatorie e alcune sono antinfiammatorie. È l’equilibrio di ciascuno, così come il modo in cui interagiscono con i loro recettori solubili affini, che determina i risultati finali del processo [ 78]. Se la risposta pro-infiammatoria supera quella antinfiammatoria, si può innescare una cascata che è stata comunemente chiamata “tempesta di citochine” [ 19 ]. Il risultato di questa travolgente risposta infiammatoria è spesso la tossicità cellulare. Oltre a indurre questa tossicità nella periferia, molte delle citochine circolanti, sebbene di grandi dimensioni, sembrano essere in grado di attraversare la barriera ematoencefalica utilizzando uno dei numerosi meccanismi. Questi meccanismi includono 1) un sistema di trasporto saturabile [ 79 ], 2) l’ingresso attraverso regioni di ridotta barriera ematoencefalica chiamate organi circumventricolari e 3) aumento della permeabilità capillare [ 80–82]. Quest’ultimo apre le strette giunzioni della barriera ematoencefalica e consente a queste grosse proteine di aggirare le protezioni tradizionalmente offerte da questa barriera.
Una volta nel cervello, queste citochine/chemochine/interferoni/TNF possono legarsi alle cellule microgliali, il che induce la loro “attivazione” [ 83 ]. Oltre a questo effetto indiretto delle citochine circolanti, numerosi studi hanno fornito supporto alla neurodegenerazione del PD che si verifica come un’invasione diretta dei linfociti circolanti (compresi i linfociti T e B) che successivamente interagiscono con le cellule infiammatorie innate del cervello. Numerosi studi osservazionali hanno riscontrato un aumento del numero di linfociti e monociti circolanti nel cervello dei pazienti con PD [ 84, 85]. Inoltre, studi preclinici hanno dimostrato direttamente la natura critica delle cellule immunitarie circolanti nella patogenesi del PD. I primi studi hanno mostrato che le tossine dopaminergiche, come 6-OHDA o MPTP, inducevano l’infiltrazione di cellule T nel cervello; e l’importanza di queste cellule nell’induzione della patologia è stata dimostrata dalla mancanza di patologia nei topi Rag-1-KO [ 84, 86, 87 ]. Un altro studio ha esaminato topi atimici che erano carenti di cellule T mature e sono stati iniettati con AAV-alfa-sinucleina. Questi animali hanno mostrato meno patologie comportamentali e anatomiche rispetto ai topi competenti con cellule T [ 88 ]. Complessivamente, questi risultati hanno dimostrato che i linfociti T maturi erano necessari per indurre patologie sia comportamentali che anatomiche.
Meccanicamente, quale potrebbe essere il legame tra le cellule del sistema immunitario periferico e il sistema immunitario innato nel cervello? Un componente critico funziona attraverso il riconoscimento di MHCII; una proteina chiave presentante l’antigene [ 89 ]. MHCII è fondamentale per la presentazione dell’antigene sia ai linfociti T (sia all’interno che all’esterno del cervello) che alle cellule microgliali situate nel SNC [ 90, 91 ]. Per quanto riguarda la microglia, è interessante notare che la SNpc contiene il più alto rapporto microglia:neuroni nel cervello [ 92]; forse portando alla sua particolare sensibilità all’infiammazione [ 93 ].
È stato dimostrato che la presentazione dell’antigene provoca la secrezione di citochine e chemochine, sia nelle cellule immunitarie periferiche che nella microglia [ 90 ]. Ciò che è importante nella patogenesi del PD è che, una volta cronicamente elevate, queste proteine possono sia avviare che mantenere l’attivazione gliale [ 94-96 ]. Una volta che la microglia e gli astrociti esprimono attivamente i loro programmi infiammatori, essi stessi secernono citochine e chemochine simili a quelle prodotte dal sistema immunitario periferico. Anche in questo caso, come in periferia, quando le proteine proinfiammatorie sono in quantità maggiore delle citochine antinfiammatorie, l’ambiente ambientale dei neuroni diventa tossico [ 97 ]. Inoltre, microglia [ 98, 99 ] e astrociti [ 100] quando attivato esprimono anche antigeni MHC e diventano fagocitici.
La suscettibilità dei gangli della base a tali reazioni può essere correlata alla densità della microglia e degli astrociti rispetto ai neuroni, che è più alta nella substantia nigra di tutte le altre regioni del cervello [ 92, 93, 101 ]. Ciò è particolarmente preoccupante poiché il meccanismo di attivazione della microglia può causare un ciclo feed-forward di raggruppamento della microglia attorno ai neuroni dopaminergici e un successivo aumento dell’attivazione [ 102 ]. Inoltre, la sovrapproduzione di alfa-sinucleina indotta dall’infezione virale può, di per sé, indurre l’attivazione della microglia [ 72]. che quindi crea una cascata feed forward che perpetua gli effetti dell’infezione. In relazione all’alfa-sinucleina, il riscontro di livelli viralmente aumentati di alfa-sinucleina mal ripiegata, a scapito dell’espressione nativa della sinucleina, può anche fornire un meccanismo per la sensibilità dei neuroni dopaminergici. Beatman et al. [ 103] ha mostrato che le cellule che esprimono l’alfa-sinucleina nativa erano resistenti al virus del Nilo occidentale o all’infezione virale dell’encefalite equina venezuelana, ma quando questa proteina è stata rimossa mediante delezione genica il cervello era molto più suscettibile alle infezioni. Un altro studio ha correlato l’espressione di alfa-sinucleina all’infezione virale e ha scoperto che i pazienti che erano stati sottoposti a allotrapianti intestinali e successivamente erano stati infettati da norovirus mostravano un’espressione significativamente più alta di alfa-sinucleina mal ripiegata [ 104 ] nell’intestino; che è stato implicato come sito di partenza per la patogenesi del PD [ 105, 106] Sulla base di questi risultati, si potrebbe immaginare un meccanismo generale mediante il quale il carico aumentato indotto dal virus (o PD) di alfa-sinucleina oligomerica mal ripiegata potrebbe distorcere il pool proteico complessivo della sinucleina nativa verso il basso. I livelli ridotti di sinucleina nativa renderebbero questi neuroni più inclini allo stress ossidativo e alla successiva morte.
Queste osservazioni forniscono meccanismi plausibili per spiegare l’infezione come fattore di suscettibilità o causale per PD. Il processo ipotizzato mediante il quale gli agenti infettivi aumentano la suscettibilità al PD è riassunto inFig. 1.Fig. 1Sulla base delle prove disponibili, è stato ipotizzato un processo mediante il quale gli agenti infettivi aumentano la suscettibilità al morbo di Parkinson.
CONCLUSIONI
Le infezioni sono un plausibile fattore di rischio per parkinsonismo e PD sia in base all’evidenza epidemiologica che scientifica di base. L’entità del rischio è sconosciuta per la maggior parte degli agenti, ma dagli studi epidemiologici disponibili sembra essere complessivamente piccola, con un rischio inferiore al raddoppio osservato nella maggior parte degli studi. Inoltre, la latenza dall’infezione al PD sembra essere molto variabile e spesso lunga. Da questi dati è difficile giustificare raccomandazioni per il monitoraggio specifico del PD in soggetti con infezione pregressa o in corso.
D’altra parte, le intuizioni fisiopatologiche fornite dall’infezione e la sua apparente relazione con la perdita di neuroni dopaminergici e quindi la suscettibilità al PD forniscono importanti indicazioni per strategie di trattamento che potrebbero essere efficaci nel periodo prodromico. Come suggerito dall’evidenza epidemiologica relativa all’epatite C, il trattamento sembra mitigare il rischio. Inoltre, i meccanismi discussi sopra attraverso i quali l’infezione può contribuire alla malattia di Parkinson non sono esclusivi dell’infezione ma condividono caratteristiche con altri insulti ambientali come esposizioni chimiche o traumi cranici, poiché ciascuno sembra indurre patologia da un meccanismo che ha la neuroinfiammazione come parte fondamentale del il processo [ 42, 107–110]. Finora i trattamenti non sono stati applicati di routine agli individui esposti al fine di gestire il rischio di future malattie neurodegenerative, ma questa potrebbe essere una strategia utile e fattibile se utilizzata in modo mirato.
CONFLITTO D’INTERESSE
Gli autori non hanno conflitti di interesse da dichiarare.
Il Dr. Smeyne riceve supporto per la ricerca dal National Institute of Neurological Disorders and Stroke e dal National Institute of Environmental Health Science.
Il Dr. Marras riceve supporto per la ricerca dalla Parkinson’s Foundation (Stati Uniti), Michael J Fox Foundation, Canadian Institutes of Health Research ed è un investigatore del sito per una sperimentazione clinica supportata da Theravance.
La dott.ssa Savica riceve supporto per la ricerca dal National Institute on Aging, dal National Institute of Neurological Disorders and Stroke e dal Mayo Clinic Small Grants Program National Center for Advancing Translational Sciences (NCATS) e Acadia Pharmaceuticals Inc.
Il dottor Noyce è finanziato dalla Barts Charity. Segnala ulteriori sovvenzioni da Parkinson’s UK, Ali-gning Science Across Parkinson’s (ASAP) e Michael J Fox Foundation (MJFF), Virginia Kieley Benefaction, sovvenzioni e supporto non finanziario da GE Healthcare e onorari personali da Bial, Britannia, AbbVie , Profilo, F. Hoffmann-La Roche e Biogen.
Informazioni sull’articolo
J Parkinsons Dis. 2021; 11(1): 31–43.Pubblicato online il 2 febbraio 2021. Prepubblicato online il 22 dicembre 2020. doi: 10.3233/JPD-202279PMCID: PMC7990414PMID: 33361610Richard J. Smeyne , un Alastair J. Noyce , b, c Matthew Byrne , un Rodolfo Savica , d e Connie Marras e, *un Dipartimento di Neuroscienze, Vickie and Jack Farber Institute of Neuroscience, Thomas Jefferson University, Philadelphia, PA, USAb Unità di Neurologia Preventiva, Wolfson Institute of Preventive Medicine, Queen Mary University of London, Londra, Regno Unitoc Department of Clinical and Movement Neurosciences, UCL Institute of Neurology, Londra, Regno Unitod Department of Neurology, Mayo Clinic, Rochester, Minnesota e Division of Epidemiology, Department of Health Sciences Research, Mayo Clinic, Rochester, MN, USAe Il programma Edmond J Safra nel morbo di Parkinson, Toronto Western Hospital e l’Università di Toronto, Toronto, Canada* Corrispondenza a: Connie Marras MD, PhD, 7-MCL 399 Bathurst St. Toronto, Ontario, M5T 2S8, Canada. Tel.: +1 416 603 6422; Fax: +1 416 603 5005; E-mail: [email protected] .Accettato 21 novembre 2020.Copyright © 2021 – IOS Press. Tutti i diritti riservatiQuesto è un articolo ad accesso aperto distribuito secondo i termini della licenza Creative Commons Attribution Non-Commercial (CC BY-NC 4.0) , che consente l’uso, la distribuzione e la riproduzione non commerciali illimitati con qualsiasi mezzo, a condizione che l’opera originale sia adeguatamente citata .Questo articolo è stato citato da altri articoli in PMC.
RIFERIMENTI
[1] Nalls MA, Blauwendraat C, Vallerga CL, Heilbron K, Bandres-Ciga S, Chang D, Tan M, Kia DA, Noyce AJ, Xue A, Bras J, Young E, von Coelln R, Simón-Sánchez J, Schulte C, Sharma M, Krohn L, Pihlstrøm L, Siitonen A, Iwaki H, Leonard H, Faghri F, Gibbs JR, Hernandez DG, Scholz SW, Botia JA, Martinez M, Corvol JC, Lesage S, Jankovic J, Shulman LM , Sutherland M, Tienari P, Majamaa K, Toft M, Andreassen OA, Bangale T, Brice A, Yang J, Gan-Or Z, Gasser T, Heutink P, Shulman JM, Wood NW, Hinds DA, Hardy JA, Morris HR , Gratten J, Visscher PM, Graham RR, Singleton AB (2019) Identificazione di nuovi loci di rischio, approfondimenti causali e rischio ereditario per il morbo di Parkinson: una meta-analisi di studi di associazione sull’intero genoma . Lancetta Neurol 18 , 1091–1102. [Articolo gratuito PMC ] [ PubMed] [ Google Scholar ][2] Chen H, Ritz B (2018) La ricerca delle cause ambientali del morbo di Parkinson: andare avanti . J Parkinsons Dis 8 , S9–s17. [ Articolo gratuito PMC ][ PubMed ] [ Google Scholar ][3] Marras C, Canning CG, Goldman SM (2019) Ambiente, stile di vita e morbo di Parkinson: implicazioni per la prevenzione nel prossimo decennio . Mov Disord 34 , 801–811. [ PubMed ] [ Google Scholar ][4] Henry J, Smeyne RJ, Jang H, Miller B, Okun MS (2010) Parkinsonismo e manifestazioni neurologiche dell’influenza nel corso del 20° e 21° secolo . Parkinsonismo Relat Disord 16 , 566–571. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][5] Casals J, Elizan TS, Yahr MD (1998) Parkinsonismo postencefalitico: una recensione . J Neural Transm (Vienna) 105 , 645–676. [ PubMed ] [ Google Scholar ][6] Rebai I, Ben Rhouma H, Kraoua I, Klaa H, Rouissi A, Ben Youssef-Turki I, Gouider-Khouja N (2015) Parkinsonismo postencefalitico e coinvolgimento selettivo della substantia nigra nell’infanzia . Brain Dev 37 , 153–157. [ PubMed ] [ Google Scholar ][7] Hawkes CH, Del Tredici K, Braak H (2007) Morbo di Parkinson: un’ipotesi a doppio colpo . Neuropathol Appl Neurobiol 33 , 599–614. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][8] Pont-Sunyer C, Hotter A, Gaig C, Seppi K, Compta Y, Katzenschlager R, Mas N, Hofeneder D, Brücke T, Bayés A, Wenzel K, Infante J, Zach H, Pirker W, Posada IJ, Álvarez R, Ispierto L, De Fábregues O, Callén A, Palasí A, Aguilar M, Martí MJ, Valldeoriola F, Salamero M, Poewe W, Tolosa E (2015) L’insorgenza dei sintomi non motori nel morbo di Parkinson (studio ONSET PD) . Mov Disordine 30 , 229–237. [ PubMed ] [ Google Scholar ][9] Pradhan S, Andreasson K (2013) Commento: infiammazione progressiva come fattore che contribuisce allo sviluppo precoce del morbo di Parkinson . Esp Neurolo 241 , 148–155. [ PubMed ] [ Google Scholar ][10] Tsui JK, Calne DB, Wang Y, Schulzer M, Marion SA (1999) Fattori di rischio professionale nel morbo di Parkinson . Può J Salute pubblica 90 , 334–337. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][11] Patrick KL, Bell SL, Weindel CG, Watson RO (2019) Esplorando la “ipotesi a colpi multipli” della malattia neurodegenerativa: l’infezione batterica arriva fino al pipistrello . Front Cell infect Microbiol 9 , 138. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][12] Mattson MP (2004) Agenti infettivi e disturbi neurodegenerativi legati all’età . Aging Res Rev 3 , 105–120. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][13] Umemura A, Oeda T, Tomita S, Hayashi R, Kohsaka M, Park K, Sugiyama H, Sawada H (2014) Il delirio e la febbre alta sono associati al deterioramento motorio subacuto nella malattia di Parkinson: uno studio caso-controllo nidificato . PLoS One 9 , e94944. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][14] von Economo K (1917) Encepahlite letargica . Wien Klin Wochenschr 30 , 581–585. [ Google Scholar ][15] McCall S, Henry JM, Reid AH, Taubenberger JK (2001) RNA dell’influenza non rilevato nei tessuti cerebrali d’archivio da casi di encefalite letargica acuta o in casi di Parkinson postencefalitico . J Neuropathol Exp Neurol 60 , 696–704. [ PubMed ] [ Google Scholar ][16] Kapila CC, Kaul S, Kapur SC, Kalayanam TS, Banerjee D (1958) Disturbi neurologici ed epatici associati all’influenza . Fr Med J 2 , 1311–1314. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][17] Hosseini S, Wilk E, Michaelsen-Preusse K, Gerhauser I, Baumgärtner W, Geffers R, Schughart K, Korte M (2018) Neuroinfiammazione a lungo termine indotta dall’infezione da virus dell’influenza A e impatto sulla morfologia e funzione dei neuroni ippocampali . J Neurosci 38 , 3060–3080. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][18] Sadasivan S, Zanin M, O’Brien K, Schultz-Cherry S, Smeyne RJ (2015) Induzione dell’attivazione della microglia dopo l’infezione con il virus dell’influenza non neurotropico A/CA/04/2009 H1N1 . PLoS One 10 , e0124047. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][19] Ferrara JL, Abhyankar S, Gilliland DG (1993) Tempesta di citochine della malattia del trapianto contro l’ospite: un ruolo dell’effettore critico per l’interleuchina-1 . Trapianto Proc 25 , 1216–1217. [ PubMed ] [ Google Scholar ][20] Harry GJ, Kraft AD (2008) Neuroinfiammazione e microglia: considerazioni e approcci per la valutazione della neurotossicità . Expert Opin Drug Metab Toxicol 4 , 1265–1277. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][21] Sulzer D (2007) Molteplici ipotesi di successo per la perdita di neuroni dopaminergici nel morbo di Parkinson . Tendenze Neurosci 30 , 244–250. [ PubMed ] [ Google Scholar ][22] Jang H, Boltz DA, Webster RG, Smeyne RJ (2009) Parkinsonismo virale . Biochim Biophys Acta 1792 , 714–721. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][23] Wang H, Liu X, Tan C, Zhou W, Jiang J, Peng W, Zhou X, Mo L, Chen L (2020) Rischio di malattia di Parkinson correlato a infezioni batteriche, virali e fungine: meta-analisi di studi di coorte e caso-controllo . Comportamento cerebrale 10 , e01549. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][24] Polidoro RB, Hagan RS, de Santis Santiago R, Schmidt NW (2020) Panoramica: La risposta infiammatoria sistemica derivata dal danno polmonare causato dall’infezione da SARS-CoV-2 spiega i gravi esiti in COVID-19 . Front Immunol 11, 1626. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][25] GBD 2015 Disease and Injury Incidence and Prevalence Collaborators (2016) Incidenza, prevalenza e anni vissuti con disabilità a livello globale, regionale e nazionale per 310 malattie e lesioni, 1990-2015: un’analisi sistematica per il Global Burden of Disease Study 2015 . Lancetta 388, 1545–1602. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][26] Forton DM, Allsop JM, Main J, Foster GR, Thomas HC, Taylor-Robinson SD (2001) Evidenza per un effetto cerebrale del virus dell’epatite C. Lancetta 358 , 38–39. [ PubMed ] [ Google Scholar ][27] Wilkinson J, Radkowski M, Laskus T (2009) Neuroinvasione del virus dell’epatite C: identificazione delle cellule infette . J Virol 83 , 1312–1319. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][28] Wu WY-Y, Kang KH, Chen SL-S, Chiu SY-H, Yen AM-F, Fann JC-Y, Su CW, Liu HC, Lee CZ, Fu WM, Chen HH, Liou HH (2015 ) Infezione da virus dell’epatite C: un fattore di rischio per il morbo di Parkinson . J Epatite virale 22 , 784–791. [ PubMed] [ Google Scholar ][29] Tsai HH, Liou HH, Muo CH, Lee CZ, Yen RF, Kao CH (2016) Infezione da virus dell’epatite C come fattore di rischio per il morbo di Parkinson: uno studio di coorte nazionale . Neurologia 86 , 840–846. [ PubMed ] [ Google Scholar ][30] Pakpoor J, Noyce A, Goldacre R, Selkihova M, Mullin S, Schrag A, Lees A, Goldacre M (2017) Epatite virale e malattia di Parkinson: uno studio nazionale di collegamento dei record . Neurologia 88 , 1630–1633. [ PubMed ] [ Google Scholar ][31] Wijarnpreecha K, Chesdachai S, Jaruvongvanich V, Ungprasert P (2018) Infezione da virus dell’epatite C e rischio del morbo di Parkinson: una revisione sistematica e una meta-analisi . Eur J Gastroenterol Hepatol 30 , 9–13. [ PubMed ] [ Google Scholar ][32] Goldstein L, Fogel-Grinvald H, Steiner I (2019) Infezione da virus dell’epatite B e C come fattore di rischio per il morbo di Parkinson in Israele-Uno studio di coorte nazionale . J Neurol Sci 398 , 138–141. [ PubMed ] [ Google Scholar ][33] Lin WY, Lin MS, Weng YH, Yeh TH, Lin YS, Fong PY, Wu YR, Lu CS, Chen RS, Huang YZ (2019) Associazione di terapia antivirale con rischio di malattia di Parkinson in pazienti con epatite cronica C infezione da virus . JAMA Neurol 76 , 1019–1027. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][34] Su TH, Yang HC, Tseng TC, Chou SW, Lin CH, Liu CH, Liu CJ, Chen CL, Kao JH (2019) La terapia antivirale nei pazienti con epatite cronica C è associata a un ridotto rischio di parkinsonismo . Mov Disord 34 , 1882–1890. [ PubMed ] [ Google Scholar ][35] Gruppo di lavoro dell’American Academy of Neurology AIDS Task Force (1991) Nomenclatura e definizioni di casi di ricerca per le manifestazioni neurologiche dell’infezione da virus dell’immunodeficienza umana di tipo 1 (HIV-1) . Neurologia 41 , 778–778. [ PubMed ] [ Google Scholar ][36] Mirsattari SM, Power C, Nath A (1998) Parkinsonismo con infezione da HIV . Mov Disordine 13 , 684–689. [ PubMed ] [ Google Scholar ][37] Tisch S, Brew BJ (2010) HIV, HAART e morbo di Parkinson: coincidenza o legame patogenetico? Mov Disordine 25 , 2257–2258. [ PubMed ] [ Google Scholar ][38] Tse W, Cersosimo MG, Gracies JM, Morgello S, Olanow CW, Koller W (2004) Disturbi del movimento e AIDS: una rassegna . Parkinsonismo Relat Disord 10 , 323–334. [ PubMed ] [ Google Scholar ][39] Heaton RK, Franklin DR, Ellis RJ, McCutchan JA, Letendre SL, Leblanc S, Corkran SH, Duarte NA, Clifford DB, Woods SP, Collier AC, Marra CM, Morgello S, Mindt MR, Taylor MJ, Marcotte TD , Atkinson JH, Wolfson T, Gelman BB, McArthur JC, Simpson DM, Abramson I, Gamst A, Fennema-Notestine C, Jernigan TL, Wong J, Grant I (2011) Disturbi neurocognitivi associati all’HIV prima e durante l’era della combinazione terapia antiretrovirale: differenze nei tassi, nella natura e nei predittori . J Neurovirol 17 , 3–16. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][40] Siangphoe U, Archer KJ, Nguyen C, Lee KR (2020) Associazioni di terapia antiretrovirale e comorbidità con esiti neurocognitivi in pazienti con infezione da HIV-1 . AIDS 34 , 893–902. [ PubMed] [ Google Scholar ][41] Dehner LF, Spitz M, Pereira JS (2016) Parkinsonismo in pazienti con infezione da HIV durante la terapia antiretrovirale – dati da un ospedale terziario brasiliano . Braz J Infect Dis 20 , 499–501. [ PubMed ] [ Google Scholar ][42] Liu B, Gao HM, Hong JS (2003) Morbo di Parkinson ed esposizione ad agenti infettivi e pesticidi e insorgenza di lesioni cerebrali: ruolo della neuroinfiammazione . Prospettiva della salute ambientale 111 , 1065–1073. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][43] Pische G, Koob M, Wirth T, Quenardelle V, Lagha-Boukbiza O, Renaud M, Anheim M, Tranchant C (2017) Il parkinsonismo subacuto come complicanza della malattia di Lyme . J Neurol 264 , 1015–1019. [ PubMed ] [ Google Scholar ][44] Blum K, Modestino EJ, Febo M, Steinberg B, McLaughlin T, Fried L, Baron D, Siwicki D, Badgaiyan RD (2017) Lyme e funzione dopaminergica: ipotizzare una sintomatologia da carenza di ricompensa ridotta regolando la trasmissione della dopamina . J Syst Integr Neurosci 3 , doi: 10.15761/JSIN.1000163 [ Articolo gratuito PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ][45] Cassarino DS, Quezado MM, Ghatak NR, Duray PH (2003) Parkinsonismo associato a Lyme: un caso di studio neuropatologico e revisione della letteratura . Arch Pathol Lab Med 127 , 1204–1206. [ PubMed ] [ Google Scholar ][46] Forrester JD, Kugeler KJ, Perea AE, Pastula DM, Mead PS (2015) Nessuna correlazione geografica tra malattia di Lyme e morte dovuta a 4 malattie neurodegenerative, Stati Uniti, 2001-2010 . Emerg Infect Dis 21 , 2036–2039. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][47] Haahr R, Tetens MM, Dessau RB, Krogfelt KA, Bodilsen J, Andersen NS, Moller JK, Roed C, Christiansen CB, Ellermann-Eriksen S, Bangsborg JM, Hansen K, Benfield TL, Ostergaard Andersen C, Obel N , Lebech AM, Omland LH (2019) Rischio di disturbi neurologici in pazienti con neuroborreliosi di Lyme europea. Uno studio di coorte nazionale basato sulla popolazione . Clin Infect Dis 71 , 1511–1516. [ PubMed ] [ Google Scholar ][48] McGee DJ, Lu XH, Disbrow EA (2018) Stomaching the possibilità di un ruolo patogeno per Helicobacter pylori nel morbo di Parkinson . J Parkinsons Dis 8 , 367–374. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][49] Schwab RS (1961) Sintomatologia e trattamento medico del morbo di Parkinson . Int J Neurol 2 , 61–75. [ PubMed ] [ Google Scholar ][50] Svensson E, Horvath-Puho E, Thomsen RW, Djurhuus JC, Pedersen L, Borghammer P, Sorensen HT (2015) Vagotomia e conseguente rischio di malattia di Parkinson . Anna Neurol 78 , 522–529. [ PubMed ] [ Google Scholar ][51] Shen X, Yang H, Wu Y, Zhang D, Jiang H (2017) Meta-analisi: Associazione dell’infezione da Helicobacter pylori con il morbo di Parkinson . Helicobacter 22 , e12398. [ PubMed ] [ Google Scholar ][52] Huang HK, Wang JH, Lei WY, Chen CL, Chang CY, Liou LS (2018) L’infezione da Helicobacter pylori è associata a un aumentato rischio di malattia di Parkinson: uno studio di coorte retrospettivo basato sulla popolazione . Parkinsonismo Relat Disord 47 , 26–31. [ PubMed ] [ Google Scholar ][53] Tan AH, Mahadeva S, Marras C, Thalha AM, Kiew CK, Yeat CM, Ng SW, Ang SP, Chow SK, Loke MF, Vadivelu JS, Ibrahim N, Yong HS, Tan CT, Fox SH, Lang AE , Lim SY (2015) L’infezione da Helicobacter pylori è associata a una gravità peggiore del morbo di Parkinson . Parkinsonismo Relat Disord 21 , 221–225. [ PubMed ] [ Google Scholar ][54] Rahne KE, Tagesson C, Nyholm D (2013) Fluttuazioni motorie e Helicobacter pylori nel morbo di Parkinson . J Neurol 260 , 2974–2980. [ PubMed] [ Google Scholar ][55] Kohbata S, Beaman BL (1991) Disturbo del movimento sensibile alla L-dopa causato da asteroidi Nocardia localizzati nel cervello dei topi . Infect Immun 59 , 181–191. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][56] Tam S, Barry DP, Beaman L, Beaman BL (2002) Neuroinvasive Nocardia asteroides GUH-2 induce l’apoptosi nella substantia nigra in vivo e nelle cellule dopaminergiche in vitro . Esp Neurolo 177 , 453–460. [ PubMed ] [ Google Scholar ][57] Kohbata S, Shimokawa K (1993) Anticorpo circolante contro Nocardia nel siero di pazienti con malattia di Parkinson . Adv Neurol 60 , 355–357. [ PubMed ] [ Google Scholar ][58] Elkind MS, Ramakrishnan P, Moon YP, Boden-Albala B, Liu KM, Spitalnik SL, Rundek T, Sacco RL, Paik MC (2010) Carico infettivo e rischio di ictus: lo studio di Manhattan settentrionale . Arch Neurol 67 , 33–38. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][59] Bu XL, Yao XQ, Jiao SS, Zeng F, Liu YH, Xiang Y, Liang CR, Wang QH, Wang X, Cao HY, Yi X, Deng B, Liu CH, Xu J, Zhang LL, Gao CY , Xu ZQ, Zhang M, Wang L, Tan XL, Xu X, Zhou HD, Wang YJ (2015) Uno studio sull’associazione tra carico infettivo e malattia di Alzheimer . Eur J Neurol 22 , 1519–1525. [ PubMed ] [ Google Scholar ][60] Hasan S, Mielke MM, Ahlskog JE, Bower J, Turcano P, Savica R (2020) Infezioni o sepsi che precedono α-sinucleinopatie clinicamente diagnosticate: uno studio caso-controllo . Mov Disord 35 , 1684–1689. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][61] Bhattacharyya D, Mohite GM, Krishnamoorthy J, Gayen N, Mehra S, Navalkar A, Kotler SA, Ratha BN, Ghosh A, Kumar R, Garai K, Mandal AK, Maji SK, Bhunia A (2019) Lipopolisaccaride di Gut Il microbiota modula l’aggregazione dell’alfa-sinucleina e altera la sua funzione biologica . ACS Chem Neurosci 10 , 2229–2236. [ PubMed ] [ Google Scholar ][62] Kim C, Lv G, Lee JS, Jung BC, Masuda-Suzukake M, Hong CS, Valera E, Lee HJ, Paik SR, Hasegawa M, Masliah E, Eliezer D, Lee SJ (2016) Esposizione a endotossine batteriche genera un ceppo distinto di fibrilla alfa-sinucleina . Sci Rep 6 , 30891. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][63] Chen SG, Stribinskis V, Rane MJ, Demuth DR, Gozal E, Roberts AM, Jagadapillai R, Liu R, Choe K, Shivakumar B, Son F, Jin S, Kerber R, Adame A, Masliah E, Friedland RP (2016) L’esposizione alla proteina amiloide batterica funzionale curli migliora l’aggregazione dell’alfa-sinucleina nei ratti Fischer 344 invecchiati e Caenorhabditis elegans . Sci Rep 6, 34477. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][64] Zhernakova A, Kurilshikov A, Bonder MJ, Tigchelaar EF, Schirmer M, Vatanen T, Mujagic Z, Vila AV, Falony G, Vieira-Silva S, Wang J, Imhann F, Brandsma E, Jankipersadsing SA, Joossens M, Cenit MC, Deelen P, Swertz MA, studio di coorte LifeLines, Weersma RK, Feskens EJ, Netea MG, Gevers D, Jonkers D, Franke L, Aulchenko YS, Huttenhower C, Raes J, Hofker MH, Xavier RJ, Wijmenga C, Fu J (2016) L’analisi metagenomica basata sulla popolazione rivela marcatori per la composizione e la diversità del microbioma intestinale . Scienza 352 , 565–569. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][65] Sampson TR, Debelius JW, Thron T, Janssen S, Shastri GG, Ilhan ZE, Challis C, Schretter CE, Rocha S, Gradinaru V, Chesselet MF, Keshavarzian A, Shannon KM, Krajmalnik-Brown R, Wittung-Stafshede P, Knight R, Mazmanian SK (2016) Il microbiota intestinale regola i deficit motori e la neuroinfiammazione in un modello di malattia di Parkinson . Cella 167 , 1469–1480 e1412. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][66] Scheperjans F, Aho V, Pereira PA, Koskinen K, Paulin L, Pekkonen E, Haapaniemi E, Kaakkola S, Eerola-Rautio J, Pohja M, Kinnunen E, Murros K, Auvinen P (2015) Il microbiota intestinale è correlato al morbo di Parkinson e al fenotipo clinico. Mov Disordine 30 , 350–358. [ PubMed ] [ Google Scholar ][67] Hasegawa S, Goto S, Tsuji H, Okuno T, Asahara T, Nomoto K, Shibata A, Fujisawa Y, Minato T, Okamoto A, Ohno K, Hirayama M (2015) Disbiosi intestinale e proteina legante i lipopolisaccaridi sierici ridotti nel morbo di Parkinson . PLoS One 10 , e0142164. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][68] Killinger BA, Madaj Z, Sikora JW, Rey N, Haas AJ, Vepa Y, Lindqvist D, Chen H, Thomas PM, Brundin P, Brundin L, Labrie V (2018) L’appendice vermiforme influisce sul rischio di sviluppare il Parkinson malattia . Sci Transl Med 10, orecchio5280. [ Articolo gratuito PMC ] [ PubMed] [ Google Scholar ][69] Marras C, Lang AE, Austin PC, Lau C, Urbach DR (2016) Appendicectomia a metà e in età avanzata e rischio di morbo di Parkinson: uno studio basato sulla popolazione . Mov Disord 31 , 1243–1247. [ PubMed ] [ Google Scholar ][70] Svensson E, Horváth-Puhó E, Stokholm MG, Sørensen HT, Henderson VW, Borghammer P (2016) Appendicectomia e rischio del morbo di Parkinson: uno studio di coorte nazionale con più di 10 anni di follow-up . Mov Disord 31 , 1918–1922. [ PubMed ] [ Google Scholar ][71] Schultz DR, Barthal JS, Garrett G (1977) Encefalite equina occidentale con rapida insorgenza di parkinsonismo . Neurologia 27 , 1095–1096. [ PubMed ] [ Google Scholar ][72] Bantle CM, Phillips AT, Smeyne RJ, Rocha SM, Olson KE, Tjalkens RB (2019) L’infezione da alfavirus trasmesso dalle zanzare induce la perdita selettiva di neuroni dopaminergici, neuroinfiammazione e aggregazione proteica diffusa. NPJ Parkinsons Dis 5 , 20. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][73] Jang H, Boltz D, McClaren J, Pani AK, Smeyne M, Korff A, Webster R, Smeyne RJ (2012) Effetti infiammatori dell’infezione da virus dell’influenza H5N1 altamente patogena nel SNC dei topi . J Neurosci 32 , 1545–1559. [ Articolo gratuito PMC ][ PubMed ] [ Google Scholar ][74] Jang H, Boltz D, Sturm-Ramirez K, Shepherd KR, Jiao Y, Webster R, Smeyne RJ (2009) Il virus dell’influenza H5N1 altamente patogeno può entrare nel sistema nervoso centrale e indurre neuroinfiammazione e neurodegenerazione . Proc Natl Acad Sci USA 106 , 14063–14068. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][75] Phillips AT, Stauft CB, Aboellail TA, Toth AM, Jarvis DL, Powers AM, Olson KE (2013) Imaging bioluminescente e caratterizzazione istopatologica della neuroinvasione WEEV in topi CD-1 outbred . PLoS One 8 , e53462. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][76] Marreiros R, Müller-Schiffmann A, Trossbach SV, Prikulis I, Hänsch S, Weidtkamp-Peters S, Moreira AR, Sahu S, Soloviev I, Selvarajah S, Lingappa VR, Korth C (2020) Interruzione della proteostasi cellulare da parte di Il virus dell’influenza A H1N1 provoca l’aggregazione dell’α-sinucleina . Proc Natl Acad Sci USA 117 , 6741–6751. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][77] Tisoncik JR, Korth MJ, Simmons CP, Farrar J, Martin TR, Katze MG (2012) Nell’occhio della tempesta di citochine . Microbiol Mol Biol Rev 76 , 16–32. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][78] Park WY, Goodman RB, Steinberg KP, Ruzinski JT, Radella F, 2nd Park DR, Pugin J, Skerrett SJ, Hudson LD, Martin TR (2001) Bilancio delle citochine nei polmoni di pazienti con sindrome da distress respiratorio acuto . Am J Respir Crit Care Med 164 , 1896–1903. [ PubMed ] [ Google Scholar ][79] Banks WA, Kastin AJ, Broadwell RD (1995) Passaggio di citochine attraverso la barriera ematoencefalica . Neuroimmunomodulazione 2 , 241–248. [ PubMed ] [ Google Scholar ][80] Basler CF (2017) Patogenesi molecolare della febbre emorragica virale . Semin Immunopathol 39 , 551–561. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][81] Steinberg BE, Goldenberg NM, Lee WL (2012) Le infezioni virali imitano la sepsi batterica? Il ruolo della permeabilità microvascolare: una rassegna di meccanismi e metodi . Antivirale Res 93 , 2–15. [ PubMed ] [ Google Scholar ][82] da Fonseca AC, Matias D, Garcia C, Amaral R, Geraldo LH, Freitas C, Lima FR (2014) L’impatto dell’attivazione microgliale sulla barriera ematoencefalica nelle malattie del cervello . Front Cell Neurosci 8 , 362. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][83] Benveniste EN, Benos DJ (1995) Vie di trasduzione del segnale mediate da TNF-alfa e IFN-gamma: effetti sull’espressione e sulla funzione genica delle cellule gliali . FASEB J 9 , 1577–1584. [ PubMed ] [ Google Scholar ][84] Brochard V, Combattente B, Prigent A, Laouar Y, Perrin A, Beray-Berthat V, Bonduelle O, Alvarez-Fischer D, Callebert J, Launay JM, Duyckaerts C, Flavell RA, Hirsch EC, Hunot S (2009 ) L’infiltrazione di linfociti CD4+ nel cervello contribuisce alla neurodegenerazione in un modello murino di morbo di Parkinson . J Clin Invest 119 , 182–192. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][85] McGeer PL, Itagaki S, Akiyama H, McGeer EG (1988) Il tasso di morte cellulare nel parkinsonismo indica un processo neuropatologico attivo . Ann Neurol 24 , 574–576. [ PubMed ] [ Google Scholar ][86] Ip CW, Beck SK, Volkmann J (2015) I linfociti riducono i deficit nigrostriatali nel modello murino 6-idrossidopamina del morbo di Parkinson . J Neural Transm (Vienna) 122 , 1633–1643. [ PubMed ] [ Google Scholar ][87] Dutta D, Kundu M, Mondal S, Roy A, Ruehl S, Hall DA, Pahan K (2019) L’invasione indotta da RANTES di cellule Th17 nella substantia nigra potenzia la perdita di cellule dopaminergiche nel modello murino MPTP del morbo di Parkinson . Neurobiol Dis 132 , 104575. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][88] Subbarayan MS, Hudson C, Moss LD, Nash KR, Bickford PC (2020) L’infiltrazione delle cellule T e la sovraregolazione di MHCII nella microglia portano a una perdita neuronale accelerata in un modello di ratto α-sinucleina del morbo di Parkinson. J Neuroinflammation 17 , 242. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][89] Jimenez-Ferrer I, Swanberg M (2018) Immunogenetica del morbo di Parkinson. Nella malattia di Parkinson: patogenesi e aspetti clinici, Stoker TB, Groenlandia JC, eds. Pubblicazioni Codon, Brisbane. [ Google Scholar ][90] Harms AS, Cao S, Rowse AL, Thome AD, Li X, Mangieri LR, Cron RQ, Shacka JJ, Raman C, Standaert DG (2013) MHCII è richiesto per l’attivazione della microglia indotta da alfa-sinucleina, CD4 T proliferazione cellulare e neurodegenerazione dopaminergica . J Neurosci 33 , 9592–9600. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][91] Sulzer D, Alcalay RN, Garretti F, Cote L, Kanter E, Agin-Liebes J, Liong C, McMurtrey C, Hildebrand WH, Mao X, Dawson VL, Dawson TM, Oseroff C, Pham J, Sidney J, Dillon MB, Carpenter C, Weiskopf D, Phillips E, Mallal S, Peters B, Frazier A, Lindestam Arlehamn CS, Sette A (2017) Le cellule T di pazienti con malattia di Parkinson riconoscono i peptidi dell’alfa-sinucleina . Natura 546 , 656–661. [ Articolo gratuito PMC ] [ PubMed] [ Google Scholar ][92] Kim WG, Mohney RP, Wilson B, Jeohn GH, Liu B, Hong JS (2000) Differenza regionale nella suscettibilità alla neurotossicità indotta da lipopolisaccaridi nel cervello di ratto: ruolo della microglia . J Neurosci 20 , 6309–6316. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][93] Smeyne M, Jiao Y, Shepherd KR, Smeyne RJ (2005) Il numero di cellule glia modula la sensibilità all’MPTP nei topi . Glia 52 , 144–152. [ PubMed ] [ Google Scholar ][94] Barcia C, Ros CM, Annese V, Gómez A, Ros-Bernal F, Aguado-Yera D, Martínez-Pagán ME, de Pablos V, Fernandez-Villalba E, Herrero MT (2011) Segnalazione IFN-γ, con il contributo sinergico del TNF-α, media l’attivazione microgliale e astrogliale specifica delle cellule nei modelli sperimentali del morbo di Parkinson . Morte cellulare Dis 2 , e142. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][95] Tansey MG, Goldberg MS (2010) Neuroinfiammazione nel morbo di Parkinson: il suo ruolo nella morte neuronale e le implicazioni per l’intervento terapeutico . Neurobiol Dis 37 , 510–518. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][96] Tansey MG, McCoy MK, Frank-Cannon TC (2007) Meccanismi neuroinfiammatori nel morbo di Parkinson: potenziali fattori scatenanti ambientali, percorsi e bersagli per un intervento terapeutico precoce . Esp Neurolo 208 , 1–25. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][97] Rothwell NJ (1999) Revisione annuale delle citochine della conferenza a premi: assassini nel cervello? J Physiol 514 ( Pt 1 ), 3–17. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][98] Hayes GM, Woodroofe MN, Cuzner ML (1988) Microglia esprimono MHC di classe II nella sostanza bianca umana normale e demielinizzante . Ann NY Accad Sci 540 , 501–503. [ PubMed ] [ Google Scholar ][99] Hayes GM, Woodroofe MN, Cuzner ML (1987) Le microglia sono il principale tipo di cellula che esprime MHC di classe II nella sostanza bianca umana . J Neurol Sci 80 , 25–37. [ PubMed ] [ Google Scholar ][100] Rostami J, Fotaki G, Sirois J, Mzezewa R, Bergström J, Essand M, Healy L, Erlandsson A (2020) Gli astrociti hanno la capacità di agire come cellule presentanti l’antigene nel cervello del morbo di Parkinson . J Neuroinflammation 17 , 119. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][101] Yang TT, Lin C, Hsu CT, Wang TF, Ke FY, Kuo YM (2013) Distribuzione differenziale e attivazione della microglia nel cervello di topi maschi C57BL/6J . Brain Struct Funct 218 , 1051–1060. [ PubMed ] [ Google Scholar ][102] Yao YY, Ling EA, Lu D (2020) Neuroinfiammazione mediata dalla microglia – regolazione della segnalazione e considerazioni terapeutiche con particolare riferimento ad alcuni composti naturali. Histol Histopathol, doi: 10.14670/HH-18-239. [ PubMed ] [ CrossRef ][103] Beatman EL, Massey A, Shives KD, Burrack KS, Chamanian M, Morrison TE, Beckham JD (2015) L’espressione dell’alfa-sinucleina limita le infezioni virali dell’RNA nel cervello . J Virol 90 , 2767–2782. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][104] Stolzenberg E, Berry D, Yang D, Lee EY, Kroemer A, Kaufman S, Wong GCL, Oppenheim JJ, Sen S, Fishbein T, Bax A, Harris B, Barbut D, Zasloff MA (2017) Un ruolo per alfa-sinucleina neuronale nell’immunità gastrointestinale . J Immunità innata 9 , 456–463. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][105] Kim S, Kwon SH, Kam TI, Panicker N, Karuppagounder SS, Lee S, Lee JH, Kim WR, Kook M, Foss CA, Shen C, Lee H, Kulkarni S, Pasricha PJ, Lee G, Pomper MG , Dawson VL, Dawson TM, Ko HS (2019) La propagazione transneuronale dell’α-sinucleina patologica dall’intestino al cervello modella la malattia di Parkinson . Neurone 103 , 627–641.e627. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][106] Braak H, Rüb U, Gai WP, Del Tredici K (2003) Morbo di Parkinson idiopatico: possibili vie attraverso le quali i tipi neuronali vulnerabili possono essere soggetti a neuroinvasione da parte di un patogeno sconosciuto . J Neural Transm (Vienna) 110 , 517–536. [ PubMed ] [ Google Scholar ][107] Acosta SA, Tajiri N, de la Pena I, Bastawrous M, Sanberg PR, Kaneko Y, Borlongan CV (2015) Alfa-sinucleina come legame patologico tra lesione cerebrale traumatica cronica e morbo di Parkinson . J Cell Physiol 230 , 1024–1032. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][108] Costa LG, Cole TB, Dao K, Chang YC, Coburn J, Garrick JM (2020) Effetti dell’inquinamento atmosferico sul sistema nervoso e suo possibile ruolo nei disturbi dello sviluppo neurologico e neurodegenerativo . Pharmacol Ther 210 , 107523. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][109] De Miranda BR, Greenamyre JT (2020) Tricloroetilene, un contaminante ambientale onnipresente nel rischio di malattia di Parkinson . Impatti del processo di Environ Sci 22 , 543–554. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ][110] Kanthasamy A, Jin H, Charli A, Velllareddy A, Kanthasamy A (2019) Neurodegenerazione dopaminergica indotta da neurotossici ambientali: un potenziale collegamento a meccanismi neuroinfiammatori compromessi . Pharmacol Ther 197 , 61–82. [ Articolo gratuito PMC ] [ PubMed ] [ Google Scholar ]