IMMUNOPATOLOGIA E QUADRI CLINICI29/10/2002
Storia Clinica
Immunopatogenesi della malattia celiaca: stato dell’arte
La malattia celiaca: una diagnosi ancora trascurata. Quadro clinico in età pediatrica La malattia celiaca dell’adulto
La malattia celiaca nell’anziano
Storia Clinica
L’interesse attuale della malattia celiaca (M.C.) deriva:
- dai molteplici e nuovi aspetti conoscitivi ad essa relati;
- dalla sua grande frequenza che sino a pochi anni fa non conoscevamo;
- dal fatto che essa, a motivo del suo notevole polimorfismo che può indurre a diagnosi erronee,
rappresenta una felice espressione dell’esigenza, emergente in medicina, ad un ritorno alla visione unitaria del malato e della sua malattia, oggi, in parte perduta.
Infatti, discipline fondamentali come la Cardiologia clinica, la Medicina interna, la Chirurgia generale, a motivo dell’enorme sviluppo delle specializzazioni e conoscenze settoriali verificatosi negli ultimi decenni, potevano sembrare svuotate di significato, in quanto gran parte delle patologie ad esse afferenti erano divenute appannaggio delle varie specialità.
Ma la necessità dell’approccio olistico al malato, la necessità di coordinare nel paziente gli apporti multidisciplinari, l’opera di prevenzione, le specifiche competenze specialistiche delle dottrine madri, deve far comprendere la modernità e la necessità di esse.
Prova concreta ne sia che casi di celiachia, proprio a motivo delle sue frequenti espressioni cliniche oligosintomatiche o su un solo organo od apparato organico, siano stati vagliati da endocrinologi, neurologi, dermatologi, gastroenterologi, ecc… senza che sia emersa la giusta diagnosi: si verifica così un ritorno alla sorpassata medicina organicistica preippocratica.
Dal punto di vista storico ricordo che Celso, nei 1° sec. a.C., introdusse il termine Koiliakos, dal greco: relativo all’intestino, nel rappresentare malattie intestinali con diarrea ribelle.
Aristeo di Cappadocia, nel 1°-2° sec. d.C. , descrisse una malattia con diarrea cronica che oggi rapportiamo suggestivamente alla celiachia.
Nel 1888 Samuel Gee descrisse la malattia nei bambini affermando che la dieta era l’aspetto principale per una corretta terapia.
Nel 1918 Still segnalò, in certi malassorbimenti, l’azione dannosa dell’alimentazione con pane.
Gli autori Bibliografia
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 1 di 18 Nel 1926 Hass descrisse l’utilizzo della dieta a base di banana nel trattamento dei bambini affetti da anoressia e diarrea.
Nel 1932 l’olandese Thjsend osservò che l’alimentazione coatta con tuberi (per guerre e carestia) faceva guarire i celiaci.
Nel 1950 Dicke descrisse una riduzione dei casi di Malattia Celiaca in Olanda durante la Seconda guerra Mondiale legata ad un minor apporto di cereali. Egli collegò la malattia all’alimentazione con glutine e, successivamente, Kamer alle gliadine del frumento.
Nel 1958 fu osservata l’associazione tra carcinoma del piccolo intestino e la M.C. (bil. Case record of the Massachussetts General hospital. New Engl.J.Med. 1958;259:491-5)
Nel 1962 Gough e coll. descrissero l’associazione tra M.C. e linfoma. (bibl. Gough KR, Read AE, Naish JM. Intestinal reticulosis as a complication of idiopatic steatorrhoea. Gut 1962;3:232-9)
O’Farrelly nel 1986 coniò il termine di enteropatia-associata a T-linfoma.
La celiachia è attualmente considerata nei paesi occidentali una comune causa di malassorbimento, esistono differenze nell’incidenza geografica, queste possono essere messe in relazione, per esempio, all’età di introduzione del glutine nella dieta, infatti una sua precoce introduzione nella dieta potrebbe alterare l’equilibrio di un sistema immunitario non ancora completamente maturo.
Circa la diffusione della malattia, nel mondo occidentale i dati non sembrano esser molto diversi da quelli italiani. Nel continente asiatico v’è un incidenza inferiore, forse in rapporto al tipo di dieta.
In passato si riteneva che la celiachia fosse appannaggio esclusivo delle popolazioni europee. Anche i caratteri somatici, quali i capelli biondi e gli occhi azzurri, venivano descritti come tipici dei soggetti affetti da M.C.. La malattia era pressoché sconosciuta tra i neri di America ed in oriente. Anche questo quadro, da un punto di vista epidemiologico si sta modificando. Grazie ai tests ematochimici di recente introduzione (AGA, EMA, anticorpi anti transglutaminasi) la frequenza della celiachia si sta modificando anche in aree del mondo quali l’Africa del nord, il Medio Oriente e l’India, si assiste in questi ani a quella che possiamo chiamare la “globalizzazione” della celiachia.. Infatti la diffusione geografica della malattia ricalca quella di cereali contenenti glutine. L’utilizzo del frumento nei paesi in via di sviluppo è notevolmente aumentato negli ultimi anni, attualmente il consumo medio di frumento in questi paesi è di Kg 63,4/anno contro Kg 29,3/anno nel 1961. Questa tendenza potrebbe essere la fase iniziale di una “pandemia” celiaca legata alla progressiva occidentalizzazione, dal punto di vista alimentare, della popolazione mondiale.
Negli indiani Punjabis la celiachia è conosciuta come “diarrea estiva”, infatti l’aumento dei sintomi legati alla celiachia si accentuano prevalentemente nel periodo estivo. Questo fenomeno è legato al fatto che le focacce preparate nel periodo invernale vengono fatte con la farina di mais, mentre quelle estive vengono preparate con la farina di grano.
In un recente lavoro Mohindra ha mostrato come l’incidenza di celiachia in 246 bambini indiani con diarrea e scarso accrescimento era del 16,6%.
In Iran, in un gruppo di 100 pazienti con diarrea cronica e sottoposti al test degli EMA, la prevalenza della malattia era di circa il 20%.
In Algeria è stata riportata la più alta frequenza mondiale di associazione tra diabete mellito di tipo I e M.C. (16-20%).
I Saharawi, popolazione di origine arabo-berbera che vive in Algeria presentano una prevalenza di celiachia non riscontrabile in altre popolazioni.
In uno studio condotto su 989 bambini di età media di 7,4+/- 3,8 anni,è stata posta diagnosi di celiachia nel 5,6% dei soggetti contro la frequenza Europea di circa 0,5-1%. In questi bambini la sintomatologia è generalmente quella classica (diarrea, ritardo della crescita, distensione addominale e anemia severa). In alcuni casi sono stati riscontrati valori di emoglobina di 3gr.%, quasi al limite della compatibilità con la vita.
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 2 di 18 La prevalenza della M.C. in Europa è stata negli anni passati riportata diversamente, con medie oscillanti tra 1:1000 e 1:4000. Nel 1992 Cavill B. e coll. Indicavano come la M.C. avesse raggiunto in Svezia l’incidenza e la prevalenza di 1:300.
Un recente studio Inglese ha riscontrato una prevalenza di M.C. nel Regno Unito pari a 1:300; mentre nel Irlanda si osservava una prevalenza pari a 1:150.
Nello stesso periodo indagini più ampie di screening di massa svolte nel nostro paese mostravano un’incidenza in Sicilia di un caso su 600 nati (1992). Successivamente Bottaro G. e coll. (1993) osservarono un’incidenza di 1:300 nati.
Nelle Marche su di un campione costituito da 5280 studenti, di età compresa tra gli 11 e i 15 anni, è stata osservata una prevalenza di 1:199 nati.
Tali risultati eclatanti hanno trovato conferma da un’indagine multicentrica nazionale, svoltasi nel periodo 1992-1995 nell’ambito della Società Italiana di Gastroenterologia ed Epatologia Pediatrica (SIGEP) su un campione di 17201 studenti del Nord, Centro e Sud Italia, che ha riportato un’incidenza di 1:184 nati.
In Italia, nel 1990 si riteneva che vi fosse un caso ogni 1000 ab. Lo screening del ’94 fece rilevare che ve n’era 1 ogni 200. Oggi sappiamo che l’incidenza della m. celiaca è di 1 ogni 100/150 ab. con un rapporto femmine/maschi di 2:1. Quindi in Italia vi sono all’incirca mezzo milione di celiaci!
Da una recente indagine promossa dall’AIC, in una famiglia in cui v’è un celiaco, nell’17% circa dei casi ve n’è un altro. Ciò indica l’importanza dell’estensione dello screening relativo ai familiari dei celiaci.
Sempre dalla stessa indagine risulta che su 584 celiaci con almeno un familiare con la stessa malattia, in circa il 55% dei casi è un parente di 1° grado, ma circa il 40% negli altri gradi di parentela. Questo dato ci induce a pensare che probabilmente lo screening familiare non deve essere limitato solamente ai parenti di primo grado.
Prima dell’introduzione della dieta priva di glutine si aveva una mortalità legata alla Malattia Celiaca pari al 10-30%; dopo l’introduzione della dieta aglutinata la mortalità è scesa a 0,4%.
L’introduzione nella pratica clinica di nuovi ed efficaci test di screening (AGA, EMA, TRANSGLUTAMINASI) e l’uso più frequente della biopsia intestinale endoscopica hanno sicuramente contribuito all’identificazione di nuove modalità di presentazione della malattia.
Una classificazione estensiva (Corazza), contempla una forma CLASSICA con sintomi enterici e sierologia e biopsia intestinali positivi; una forma ATIPICA con manifestazioni extraintestinali e sierologia e biopsia positivi; una forma silente con soli reperti bioptici e sierologici positivi; una forma latente con sola sierologia positiva; una forma potenziale che riguarda i soggetti a rischio dove la predisposizione genetica può favorire i processi immunologici che portano alla M.C.
Dall’analisi dei dati di un’indagine promossa dal “Club del Tenue” si osserva una prevalenza globale delle forme atipiche del 24,1% con un aumento costante nel corso degli anni, passando dal 15,3% del 1990 al 30,1% del 1994.
La M.C. ha una forte impronta genetica, è sicuramente una delle più frequenti malattie su base genetica che conosciamo, infatti si presenta in un individuo su 100-300. Infatti è stata dimostrata una forte associazione della malattia celiaca con i geni del complesso HLA II codificanti gli eterodimeri DQ2 e DQ8; nel 90% dei celiaci è presente l’aplotipo DQ2, mentre nella maggior parte dei celiaci DQ2-negativi riscontriamo la positività per il DQ8. Gli stessi alleli sono osservati anche nel 25-30% dei familiari sani dei celiaci; infatti la presenza degli alleli HLA è un indicatore di predisposizione alla M.C. ed è essenziale per la patogenesi della malattia.
Nell’individuo portatore degli alleli HLA, la proteina codificata forma un eterodimero proteico con due unità alfa-beta destinato al riconoscimento degli antigeni estranei; il glutine e i suoi derivati peptici innesca una specifica reazione immunitaria di intolleranza che viene indirizzata contro le cellule della mucosa intestinale.
Il controllo genetico della malattia è confermato dal fatto che l’8-10% dei familiari delle persone affette da
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 3 di 18 M.C. presenta la malattia; inoltre quando un gemello omozigote è affetto da M.C., la patologia è presente nell’altro gemello nel 75% dei casi. Nel bambino prevale od è esclusiva la sintomatologia enterica che appare dopo qualche mese dallo svezzamento e dopo un certo periodo di alimentazione con glutine. Il malassorbimento conseguente è di varia entità e produce più o meno gravi conseguenze e sintomi carenziali sino all’arresto dello sviluppo.
Nell’adulto e nell’anziano le neoplasie esofagee, intestinali ed il linfoma del tenue, sono più frequenti nel celiaco che nella popolazione generale, così è per malattie autoimmuni quali la cirrosi biliare primitiva e la colangite sclerosante. Particolarmente nell’adulto, con una incidenza di circa 3/1, le forme extraintestinali prevalgono su quelle addominali. Spesso sono presenti le forme silenti o paucisintomatiche. atipiche del 24,1% con un aumento costante nel corso degli anni, passando dal 15,3% del 1990 al 30,1% del 1994.
Le Malattie autoimmuni come il diabete mellito di tipo 1°(presente nel 5% dei celiaci) e la tiroidite tipo Hasimoto (sino a 13-17% dei casi).
Particolarmente fastidiose sono le dermatiti erpetiformi e l’alopecia,; l’osteoporosi con le sue rovinose conseguenze è carenziale.
Anche l’apparato cardiovascolare può essere coinvolto nella malattia, infatti nei soggetti affetti da malattia celiaca si osserva un prolungamento del Q-T con conseguente predisposizione ad aritmie, cardiopatie congenite, prolasso mitralico, pericarditi, cardiomiopatia dilatativi, cardiopatia ischemica e stroke. Le donne celiache presentano alterazioni del ciclo mestruale, della comparsa del menarca e della menopausa, sterilità ed abortività.
Sono soggetti a rischio i familiari dei celiaci, i diabetici 1° tipo, pazienti con sindrome di Dawn o di Turner o con deficit di IgA( nei quali l’insorgenza della celiachia sembra arrivare a 100 volte rispetto alla popolazione).
Da sottolineare l’importanza della dieta che deve essere rigorosamente senza glutine deve mirare a riequilibrare le carenze nutrizionali presenti nella M.C..
Per concludere, lo screenig della Celiachia dovrebbe essere estesa a quei soggetti a rischio che sono stati segnalati. Abbiamo oggi nuovi mezzi diagnostici quali il test genetico per l’HLA DQ2/DQ8, gli AGA, EMA, gli anticorpi anti Transglutaminasi utili, insieme all’esame istologico, per lo screening e la diagnosi di celiachia.
Domenico Lombardi
Dipartimento di Medicina, Ospedale Cristo Re, Roma
Immunopatogenesi della malattia celiaca: stato dell’arte
E’ noto ormai da tempo che il fattore scatenante della malattia celiaca è rappresentato dal glutine, la componente proteica della farina di frumento, orzo, segale e avena.
In particolare si è visto che la frazione tossica del glutine di frumento è rappresentata dalla sua componente alcool solubile: la gliadina. Nell’ambito di questa si distinguono quattro sottofrazioni elettroforetiche Alfa, Beta, Gamma, Omega gliadina.
Le gliadine sono costituite da singole catene polipeptidiche, di peso molecolare
compreso tra i 30.000 e 75.000 dalton e sono caratterizzate da un alto contenuto di
glutamina e prolina (32-56 glutamine e 15-30 proline ogni 100 residui amminoacidici).
Poiché l’Omega gliadina, la frazione meno tossica, ha il più alto contenuto di glutamina e prolina, la ricchezza di questi amminoacidi non sembra correlarsi con la lesività dell’intera molecola.
Molto simili alla gliadina sono le prolamine, cioè la componente alcool-solubile del glutine di orzo, segale e avena rispettivamente definite Ordeina, Secalina e Avenina.
Gli autori Bibliografia
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 4 di 18 L’isolamento di cloni di DNA complementare per la gliadina ha permesso di sequenziare e determinare i 266 amminoacidi costituenti l’A. gliadina, che è una sottofrazione tossica dell’Alfa-gliadina. Mediante digestione cianobromidica e triptica sono state identificate nell’ambito dell’A gliadina due sequenze (1.30 e 31.55) tossiche in vitro e caratterizzate dalla frequente ricorrenza di due tetrapeptidi (-gln-gln-gln-pro e pro-ser-gln- gln). L’importanza di questi 2 oligopeptidi è indirettamente confermata dalla loro assenza in cereali non tossici, quali mais e riso, e dal fatto di non poter essere ulteriormente digeriti da parte di enzimi attivi in vivo, quali pepsina, tripsina, chimotripsina, pancreatina ed endoproteinasi.
Recentemente sono stati sintetizzati tre peptidi corrispondenti ai residui 3.21, 31.49,
202.220 dell’A.gliadina. Solo la somministrazione in vitro del secondo contenente la
sequenza gln.gln.gln.pro ma non quella -pro-ser.gln.gln. contenente nel primo e nel
terzo, ha riattivato le lesioni intestinali in un gruppo di celiaci in dieta priva di glutine.
Questa sequenza quindi del peptide 31.49 dell’A.gliadina è ora considerata
l’agente lesivo della malattia celiaca. L’importanza di questo peptide nella
patogenesi della M.C. è ulteriormente confermata dal fatto che esso viene riconosciuto da linfociti T gliadina specifici DQ2 ristretti.
Anche le prolamine quindi, contenute in cereali tassonomicamente affini al frumento, quali l’orzo e la segale, simili alle gliadine per l’alcool solubilità e l’alto contenuto di glutamine e proline, risultano tossiche per l’intestino dei celiaci.
Pertanto, sul piano pratico, con il termine glutine si intendono correntemente le prolamine presenti nel frumento (gliadine), nell’orzo (ordeine), e nella segale (secaline). Recentemente è stata chiarita la non tossicità dell’avenina contenuta nell’avena. E’ ormai chiaro che nella patogenesi della M.C. i fattori genetici sono importanti tanto quelli ambientali. Familiari di I° grado di pazienti celiaci hanno infatti una prevalenza di M.C. di circa il 10% e tale prevalenza sale al 30% quando si considerano fratelli e sorelle HLA identici. La concordanza molto elevata, ma non assoluta (70%) tra gemelli monozigoti conferma l’importanza dei fattori ambientali nell’insorgenza della malattia celiaca.
La Malattia Celiaca è stata in precedenza associata con i geni codificanti le molecole HLAB8.DR3.DR7. Successivamente è stato chiarito che l’associazione primaria è con i geni codificanti la molecola di II classe HLA DQ2 e che le associazioni precedentemente osservate debbano ritenersi secondarie a quelle con il DQ2 secondo un “linkage disequilibrium”. L’eterodimero Alfa/Beta Associato alla M.C. è codificato dai geni DQA1O501 e DQB1O201 localizzato in Cis cioè sullo stesso cromosoma, in pazienti HLA D3 positivi, o in trans,cioè su cromosomi opposti nei pazienti terozigoti DR5/DR7 positivi.
I pazienti che non hanno l’aplotipo DQ2 presentano, nella maggior parte dei casi, l’aplotipo DR4
DQ8 coodificato dai geni DQ A1 O 301 e DQB1 0302. I geni HLA sono di particolare importanza per il corretto controllo della risposta immune. Sono infatti le molecole HLA di
II° classe codificate da tali geni che, configurate come un calice sulla superficie delle cosidette
cellule antigene presentanti (macrofagi, cellule APC) presentano l’antigene al recettore posto sulla superficie dei linfociti T. Si è visto altresì che la codifica sia dei geni DQ2 che DQ8 determinerebbe la sostituzione di un acido aspartico in posizione 57 della catena Beta e la presenza di una serina in posizione 75 della catena alfa tale da determinare un ruolo di fondamentale importanza per il corretto legame con l’antigene. Questo condizionerebbe una non corretta presentazione dei peptidi della gliadina al TCR dei linfociti scatenando una alterata risposta immunologica nei suoi confronti. La presenza tuttavia dei geni DQ2 e DQ8 positivi viene considerata una condizione necessaria ma non sufficiente per lo sviluppo della malattia. Una parte consistente della popolazione generale è infatti DQ2 e DQ8 positiva senza che ciò si traduca in una forma franca di M.C.
Anche la diversa concordanza tra gemelli monozigoti e fratelli HLA identici (70% vs 30%) suggerisce, inoltre, che anche geni non appartenenti al complesso maggiore di istocompatibilità debbano essere implicati nelle patogenesi della M.C. Ci sarebbero, infatti, oltre ai geni HLA, che partecipano al controllo della risposta T cellulare verso un determinante antigene, geni preposti alla preparazione ed al trasporto di quest’ultimo e geni che determinano il polimorfismo del recettore per l’antigene su linfociti T e geni immunomodulanti, che codificano per molecole di adesione, citochine e loro recettori, amplificando o restrigendo la risposta immune in modo non antigene-specifico.
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 5 di 18 Un’altra ipotesi di suscettibilità genetica non HLA correlato potrebbe essere determinata dal sistema di inibizione – attivazione CTLA-4-CD28 presente in altre patologie autoimmunitarie e non ultima l’ipotesi alternativa non legata a fattori genetici quanto piuttosto al cointervento di altri fattori ambientali, in particolare virus.
Allo stato attuale, però, vi è consenso unanime massima che l’ipotesi virale, per quanto elegante, non poggi su basi concrete.
Molto recentemente è stato dimostrato che anche la transglutaminasi tissutale (tTG), antigene degli anticorpi antiendomisio, possa avere un ruolo importante nella patogenesi della M.C. Esso è un enzima citoplasmatico che apparteneva alla famiglia degli enzimi calciodipendenti che catalizzano il cross linking proteico con la gliadina.
Sulla base di questa elevata affinità tra tTG e gliadina, è stato suggerito che, dal legame tra queste 2 molecole, si formino dei neoepitopi in grado di innescare quella risposta immune che sta alla base della malattia celiaca, tuttavia, al momento attuale non vi sono evidenze sufficienti per stabilire se questo enzima abbia un ruolo primario nella patogenesi della M.C. o meno. I meccanismi immunologici quindi, come sopra descritto, avrebbero un ruolo fondamentale nella patogenesi di questa malattia
e determinerebbero alterazioni che si riscontrerebbero nella mucosa di questi pazienti, o dagli stessi trattati a GFD che reintroducono alimenti contenenti gliadina e/o prolamine.
L’attivazione immunologica scatenata da quest’ultima determinerebbe una rapida attivazione dei linfociti T gliadina specifici DQ2 ristretti della lamina propria ed un aumento degli stessi a livello intraepiteliale. Tali linfociti, una volta attivati, produrrebbero un pattern di citochine di tipo Th1 caratterizzato dalla sovrapproduzione di IFN gamma, IL2, IL6 e TNF alfa responsabile delle lesioni intestinali quali l’ipertrofia delle cripte e l’atrofia dei villi.
CONCLUSIONI:
In questo piccolo abstract si è cercato di ricostruire, sulla base dei dati (non sempre tra loro concordanti) emersi dalla più recente letteratura, il complesso mosaico di eventi attraverso i quali, in individui geneticamente suscettibili, l’ingestione di gliadina porta all’appiattimento della mucosa intestinale.
Se il ritmo delle nuove acquisizioni si manterrà sui livelli attuali è probabile che assisteremo nei prossimi anni al definitivo chiarimento di quei punti tuttora lacunosi e controversi.
Gian Marco Giorgetti
U.O. Nutrizione Clinica, Ospedale S.Eugenio, Roma
Antonio Tursi
Divisione di Medicina Interna, Ospedale L.Bonomo, Andria
Giovanni Brandimarte
Divisione di Medicina Interna, Servizio di Endoscopia Digestiva, Ospedale Cristo Re, Roma
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 6 di 18 La malattia celiaca: una diagnosi ancora trascurata. Quadro clinico in età pediatrica
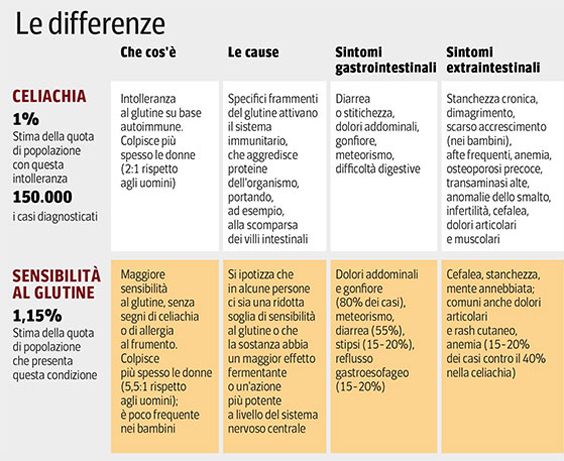
Le manifestazioni cliniche della malattia celiaca (MC) sono molteplici; l’evoluzione delle conoscenze scientifiche avvenuta in questi ultimi anni ha permesso di inquadrare in maniera più completa la celiachia in tutti i suoi aspetti, anche se l’estrema eterogenicità delle diverse forme cliniche (quadri atipici o silenti) può rendere difficile o, comunque, tardiva la diagnosi.
Prima di esaminare in dettaglio il quadro clinico va segnalato che indagini di screening hanno evidenziato che, almeno in età pediatrica, la MC è una delle patologie croniche più frequenti in assoluto.
A questo proposito va citato uno studio multicentrico italiano condotto da Catassi e collaboratori su oltre 17.000 studenti con un’età compresa tra gli 11 ed i 14 anni: dai risultati di questo studio emerge che nel nostro paese la prevalenza della MC è molto elevata: 1 caso ogni 180 soggetti.
Un altro dato sorprendente è che, per ogni caso di celiachia correttamente diagnosticato, ve ne sono 7 che sfuggono alla diagnosi clinica.
La diffusione nella pratica clinica di test diagnostici dotati di alta sensibilità e specificità, quali la determinazione degli anticorpi anti-gliadina (AGA), anticorpi anti-endomisio (EMA) e anticorpi anti- transglutaminasi (Ac anti-tTG), consente di individuare agevolmente, indipendentemente dalla modalità di presentazione clinica, tutti i casi di MC, che vanno, comunque, confermati dalla biopsia intestinale.
La celiachia è una patologia multifattoriale legata fondamentalmente a due fattori: uno intrinseco al paziente, rappresentato dalla predisposizione genetica, ed il secondo esogeno o, meglio, ambientale, costituito dalla presenza nella dieta di una proteina o, più precisamente, di un complesso proteico particolare: il GLUTINE.
La MC può manifestarsi a qualsiasi età, ma di solito i sintomi si presentano fra il 6° ed il 15° mese di vita, cioè dopo la somministrazione di alimenti contenenti glutine, con un esordio, nella forma tipica, generalmente a distanza di alcuni mesi dall’introduzione.
La MC può essere definita, quindi, come un’intolleranza permanente al glutine ed alle proteine affini in soggetti geneticamente predisposti.
Le conoscenze attuali permettono di riconoscere diverse forme cliniche di celiachia: - FORMA TIPICA 2. FORMA ATIPICA 3. FORMA SILENTE 4. FORMA LATENTE
MALATTIA CELIACA TIPICA
Il sintomo che caratterizza l’esordio della forma tipica è la diarrea. Può essere acuta oppure cronica con inizio insidioso; le feci sono abbondanti, maleodoranti, lucide, chiare, ricche di acqua; le evacuazioni sono spesso numerose anche se talora può essere presente una sola evacuazione giornaliera abbondante. Raramente il sintomo principale può essere una stipsi ostinata.
In alcuni casi la diarrea può assumere particolare gravità con disidratazione e shock (crisi celiaca). A questi sintomi possono associarsi anoressia, dolori addominali, vomito, arresto della crescita o addirittura calo ponderale; l’addome si presenta espanso, globoso e contrasta con la magrezza degli arti inferiori e dei glutei; talora sono presenti edemi agli arti inferiori ed alle palpebre e spesso vi sono alterazioni dell’umore e del carattere con irritabilità o addirittura apatia, che può in certi casi simulare un atteggiamento autistico.
Tale quadro è attualmente sempre meno frequente perché grazie a test sierologici semplici ed affidabili ed all’evoluzione delle conoscenze scientifiche, la diagnosi di celiachia è sempre più precoce.
Gli autori Bibliografia
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 7 di 18 MALATTIA CELIACA ATIPICA
Nella forma atipica si ha una prevalenza dei sintomi extraintestinali, con assenza di diarrea; le manifestazioni cliniche sono secondarie al malassorbimento e comprendono: bassa statura, anemia da carenza di ferro o di acido folico, non rispondenti alla terapia orale, rachitismo, osteoporosi, displasia dello smalto dentario, che può variare da alterazioni cromatiche a presenza di solchi e picchiettature fino alla perdita totale dello smalto. Altri sintomi della forma atipica sono rappresentati da: dolori addominali ricorrenti, aftosi recidivante, ritardo puberale, stipsi, ipertransaminasemia idiopatica, sindromi emorragiche, alopecia.
Da uno studio multicentrico presentato al 51° Congresso Nazionale della Società Italiana di Pediatria del 1995, a cui hanno aderito 33 Centri pediatrici, è emerso che la prevalenza globale delle forme atipiche è del 23,2%. I disturbi più frequenti sono: l’anemia sideropenica (36%), bassa statura (30,2%), anoressia (13%); seguono poi una serie di altri sintomi con una percentuale variabile dallo 0,4% al 4%.
Da notare che ad un’attenta anamnesi il 42,4% di questi bambini aveva accusato dei sintomi in età precedente (il 40,1% entro il 2° anno) che non avevano portato alla diagnosi; questo sta a dimostrare che i casi atipici rappresentano una percentuale importante della celiachia del bambino.
MALATTIA CELIACA SILENTE
E’ caratterizzata dalla presenza di lesioni della mucosa intestinale tipiche della celiachia in assenza di sintomatologia, che regrediscono dopo dieta priva di glutine. L’esistenza di queste forme clinicamente silenti è stata dimostrata dallo screening dei familiari di 1° grado asintomatici di pazienti celiaci e da studi di screening su studenti.
Circa il 10-15% dei parenti di primo grado asintomatici di soggetti celiaci presenta una mucosa intestinale atrofica.
MALATTIA CELIACA LATENTE
Per MC latente si vuole indicare una variante clinica in cui la malattia esiste ma non si è ancora manifestata. Si tratta di soggetti che al momento della diagnosi presentano una mucosa intestinale normale in presenza di marcatori anticorpali positivi. Questi pazienti non vengono sottoposti ad un regime dietetico privo di glutine, ma è opportuno monitorizzarli nel tempo per poterli identificare e trattare prima della comparsa di complicazioni, che potrebbero essere la prima manifestazione clinica della celiachia.
Alcuni studi hanno evidenziato in questi soggetti caratteristiche sieriche ed immunologiche (presenza di AGA ed EMA nel siero, incremento del numero dei linfociti intraepiteliali, con recettori, aumento delle cellule CD25+ della lamina propria) e genetiche (fenotipo HLADQA10501 e DQB10201) tipiche della celiachia.
I pazienti con malattia celiaca latente a distanza di tempo presenteranno un’atrofia della mucosa intestinale, che regredisce dopo dieta priva di glutine.
PATOLOGIE ASSOCIATE
Molte malattie ben conosciute risultano essere associate alla celiachia. Tra queste in età pediatrica segnaliamo: il diabete mellito insulino-dipendente (2,7%) e la sindrome di Down (10%). Tra le altre patologie più frequentemente associate alla MC vanno inoltre ricordate: tiroiditi autoimmuni, morbo di Addison, nefropatia da IgA, porpora trombocitopenica autoimmune, anemia emolitica autoimmune, artrite reumatoide giovanile, sindrome di Turner, sindrome di Williams, epilessia (con o senza calcificazioni endocraniche), psoriasi, dermatite erpetiforme.
In presenza di tali patologie è sempre necessario ricorrere ad un programma di screening per anticipare la diagnosi di malattia celiachia e evitare le complicanze.
CONSIDERAZIONI CONCLUSIVE
All’inizio del 3° millennio la celiachia ci appare sotto un aspetto multiforme: non solo come sindrome da malassorbimento intestinale, ma anche come affezione spesso clinicamente sfumata, caratterizzata da
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 8 di 18 disturbi modesti o del tutto atipici, e talora associata a varie condizioni patologiche.
Nel corso degli ultimi anni diversi studi hanno dimostrato come la MC possa sfuggire alla diagnosi, soprattutto nelle forme atipiche o silenti, e che nel paziente adulto l’unica modalità d’esordio può essere rappresentata da alcune complicanze che la caratterizzano.
La celiachia è la più comune intolleranza permanente conosciuta ed è nel bambino una delle affezioni croniche più frequenti in assoluto.
Dallo 0.5 all’1% della popolazione che consuma glutine ne risulta affetta. Al momento attuale la maggior parte dei soggetti celiaci, dal bambino all’adulto, non viene riconosciuta da una appropriata diagnosi e non riceve il trattamento dietetico che sappiamo essere risolutivo. Alcuni dati statistici italiani indicano che a fronte di 30-40.000 casi diagnosticati attualmente, ne esistono altri 300.000 non ancora individuati.
Bisogna estendere lo screening a tutta la popolazione in maniera sistematica?
La maggior parte degli autori concorda sulla necessità di individuare tutti i casi di celiachia, che possono sfuggire alla diagnosi clinica, ma non si può prescindere da una considerazione: bisogna approntare un programma di indagine guidata, che consenta l’individuazione dei casi sfuggiti alla diagnosi, con il miglior rapporto tra costi e benefici, non perdendo di vista il peso psico-sociale di un trattamento con dieta aglutinata.
Ciò si può realizzare attraverso una cultura della celiachia come malattia sistematica, che può coinvolgere vari organi ed apparati, riservando quindi il programma di screening ai gruppi di popolazione a rischio: familiari di 1° grado del celiaco, soggetti con sintomi indicativi di una forma sfumata atipica, pazienti con determinate patologie associate.
Dobbiamo ricercare i celiaci mancanti, affinché la dieta senza glutine permetta o una remissione totale della sintomatologia, o un miglioramento e/o la guarigione della patologia associata, e fare in modo che la sintomatologia d’esordio non sia una delle complicanze talora severe della MC.
In che modo?
Utilizzate più spesso AGA, EMA e Ac anti-tTG.
Evitate di consegnare all’internista dell’adulto una diagnosi tardiva di celiachia, che oltre al fallimento diagnostico del pediatra, comporta innegabili danni derivanti dalla prolungata esposizione al glutine.
Per concludere fra le prospettive future c’è quella della realizzazione di un vaccino. Alcuni ricercatori ritengono di avere individuato il peptide dominante verso il quale è diretta la risposta immune in corso di riesposizione al glutine. Tale scoperta potrebbe riaprire la strada alla terapia immunomodulatrice. Allo stato attuale, tuttavia, esistono notevoli divergenze nell’interpretazione di questi risultati e solo l’ampliamento delle conoscenze consentirà di ottenere indicazioni utili per stimolare ed orientare la ricerca in tal senso.
Dante Parenti
Neonatologia, Ospedale Cristo Re, Roma
M.E. Scapillati
Neonatologia, Ospedale Cristo Re, Roma
La malattia celiaca dell’adulto
La malattia celiaca (M.C.) è una malattia infiammatoria cronica dell’intestino scatenata dall’assunzione di glutine.
E’ caratterizzata, nella forma classica, da una mucosa con atrofia dei villi intestinali, iperplasia delle cripte e conseguente sindrome da malassorbimento. Ai classici sintomi “intestinali” quali diarrea, steatorrea, vomito,
Gli autori Bibliografia
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 9 di 18 La sintomatologia
Diarrea cronica con steatorrea, dolori addominali, meteorismo, epigastralgia, vomito, dispepsia Calo ponderale, astenia (anemia)
Artralgia, mialgia, fratture
Secchezza della cute (Dermatite erpetiforme), orticaria, alopecia
Disturbi della memoria, neuropatia periferica, epilessia Depressione (10,6%)
Sterilità, disturbi del ciclo mestruale, aborti ripetuti Afte orali
Secchezza delle mucose (Sjogren) Cefalea, cervicalgia, lombalgia. Bassa statura, ritardo della crescita
epigastralgia, dispepsia e perdita di peso si possono associare l’anemia sideropenica, l’osteoporosi, l’alopecia, la depressione, la cefalea, l’infertilità, i dolori articolari ecc…
Non è ancora ben definito il limite tra patologie sistemiche associate alla M.C. e le sue complicanze, infatti nessuna di queste ultime è esclusiva della M.C. e può essere associata ad altre condizioni morbose, mentre le patologie considerate manifestazioni sistemiche rispondono alla dieta priva di glutine in modo più soddisfacente rispetto ad alcune complicanze.
Tra le patologie e le complicanze a carico dell’apparato digerente associate alla M.C. ricordiamo: - Le coliti microscopiche quali la colite linfocitaria e la colite collagena; è stato ipotizzato che la prima rappresenti in realtà lo stadio acuto di un’unica malattia che successivamente cronicizza in colite collagena. Sono più frequenti nel sesso femminile e giustificano circa il 2,5% delle diarree croniche con colonscopia macroscopicamente normale. Dal punto di vista istologico la colite linfocitaria è caratterizzata da un aumento dei linfociti intraepiteliali, la colite collagena presenta invece una spessa banda di collagene sottoepiteliale presente principalmente nel colon prossimale, malattie infiammatorie intestinali.
- Le malattie epatiche quali la colangite primitiva sclerosante e la cirrosi biliare primitiva. Bordella e coll. nel 1997 hanno studiato un gruppo di pazienti affetti da cirrosi biliare primitiva eseguendo dosaggi degli anticorpi anti endomisio (EMA) e le biopsie della seconda porzione duodenale (DII) con un riscontro di M.C. pari all’11% dei pazienti. La correlazione tra i due processi morbosi e la M.C. resta al momento sconosciuta anche se per entrambe è stata sospettata una patogenesi immunologica. Sono descritte in letteratura ipertransaminasemie con o senza steatosi che regrediscono con dieta senza glutine.
- La M.C. è la causa più frequente di anomalie della funzione splenica legata ad atrofia acquisita dell’organo; in tutti i pazienti con una ipofunzione splenica è aumentato il rischio di complicanze tromboemboliche ed infettive.
- La precisa prevalenza delle neoplasie nella Malattia Celiaca non è ancora ben conosciuta. Infatti non tutti i celiaci con sintomi lievi o atipici vengono diagnosticati e in non tutti i pazienti affetti da neoplasia viene indagata la presenza della M.C.
Le neoplasie dell’apparato digerente più frequentemente associate alla M.C. sono il linfoma generalmente di tipo T, l’adenocarcinoma del tenue, il cancro faringeo ed esofageo. Il rischio di neoplasia faringea ed esofagea è di circa 10 volte più elevato che nella popolazione normale, quello per il linfoma risulta aumentato di 40 volte, mentre per l’adenocarcinoma del tenue è ancora più elevato. La stimolazione immunologica e l’aumentata permeabilità intestinale sono elementi a favore della teoria biologica che sostiene la possibilità di un aumentato rischio per il linfoma e l’adenocarcinoma del tenue.
Dai dati presenti in letteratura dal 1941 al 1997 la prevalenza delle neoplasie nei celiaci è compresa tra il 3% ed il 21% mentre quella del linfoma è compresa tra 0% e 9% (Tabella 1).
In uno studio prospettico condotto da Holmes su 673 pazienti celiaci diagnosticati tra il 1958 e il 1999 furono riscontrati 10 linfomi (1,5%), di cui 5 interessavano il piccolo intestino, e 24 neoplasie a carico dell’apparato digerente (3,5%). (Tabella 2).
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 10 di 18 In un altro studio prospettico di coorte condotto su 210 pazienti da Holmes GKT e coll. nel 1989 fu osservata una riduzione statisticamente significativa del fattore di rischio neoplastico nei pazienti che effettuavano una dieta rigorosa senza glutine, mentre non fu osservata nessuna differenza statisticamente significativa tra i pazienti che non effettuavano la dieta e quelli che la seguivano saltuariamente o non rigorosamente. Per quanto detto esiste unanimità tra i medici secondo cui tale rischio resta sufficientemente significativo da giustificare il rispetto di una dieta rigorosa anche nei pazienti asintomatici.
TABELLA 1. Prevalenza di neoplasie nella Malattia Celiaca
ANNO
n° casi di M.C.
Neoplasie
N°pazienti
%
16
7
21
9
8
5
8
8
3
0
5
3
Referenze
1941-65
202
neoplasie
32
Austad WI 1967
linfoma
14
1941-75
202
neoplasie
43
Holmes GKT 1976
linfoma
18
1969-81
198
neoplasie
16
O’Discoll BRC 1982
linfoma
10
1969-94
166
linfoma
13
Ilyas M. 1995
1972-94
400
linfoma
31
Egan LJ 1995
1980-90
335
neoplasie
10
Ilyas M. 1995
linfoma
0
1980-97
216
neoplasie
10
Cottone M. 1999
linfoma
7
Linfomi
10
24
2
2
2
2
4
1
3
1
7
Carcinomi gastrointestinali
Lingua
Esofago
Digiuno
Pancreas
Retto
Parotidi
Stomaco
Epatoma
Colon
TABELLA 2. Linfoma e carcinomi intestinali in 673 pazienti celiaci nell’area di Derby dal 1958 al 1999
Le patologie extraintestinali associate alla M.C. sono: - Le malattie autoimmuni quali il diabete mellito insulino dipendente, le tireopatie, le afte buccali, la
sarcoidosi, il pioderma gangrenoso, l’Addison, l’alopecia e le malattie atopiche. - Le patologie dermatologiche quali la dermatite erpetiforme, l’alopecia, la vasculite necrotizzante cutanea e la sclerodattilia.
- L’oligoartrite siero negativa con interessamento preferenziale di caviglie, ginocchia e colonna lombare che può anche precedere la comparsa della M.C., l’osteoporosi, l’artrite reumatoide.
- Le manifestazioni neurologiche, più frequenti nel sesso maschile, quali l’atassia, la neuropatia periferica, la miopatia, la mielopatia, la demenza, l’epilessia, le calcificazioni cerebrali, la leucoencefalopatia progressiva multifocale.
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 11 di 18 - La depressione
- L’insonnia
- Alterazioni dello sviluppo dentale
L’ipoplasia dello smalto è il segno perenne di un momento di alterata mineralizzazione dello smalto. Il fenomeno ipoplasico può manifestarsi, a seconda della gravità, da un semplice mutamento del colore verso il bianco gessoso o verso il grigio e il bruno, a zone di perdita di sostanze, fino ai gravi casi di assenza completa dello smalto. - Infertilità, aborti ripetuti, alterazioni del ciclo mestruale
- L’anemia sideropenica legata principalmente al malassorbimento intestinale di ferro.
Accanto alla forma classica la M.C. può essere suddivisa in altre 4 forme:
la forma subclinica caratterizzata dalla positività agli AGA, EMA ed all’istologia intestinale con sintomi esclusivamente extraintestinali;
la forma silente caratterizzata dalla positività ai marcatori sierologici ed all’istologia senza senza sintomi;
la forma latente con positivtà agli AGA ed EMA e con istologia negativa;
la forma potenziale in cui sono inseriti i parenti di I° grado dei celiaci, i pazienti con sindrome di Down, con diabete insulino dipendente, tireopatie ecc…
Diagnosi differenziale
La diagnosi differenziale della M.C. include le altre cause di malassorbimento e le altre malattie gastrointestinali associate con modificazioni della morfologia digiunale.
L’insufficienza pancreatica, secondaria a pancreatite cronica, è una comune causa di malassorbimento ma, a differenza della M.C., presenta all’ecografia calcificazioni pancreatiche e la biopsia digiunale risulta sempre nella norma.
Il morbo di Wipple si distingue facilmente dalla M.C. per le tipiche alterazioni istologiche a carico della mucosa intestinale (macrofagi ripieni di granuli PAS positivi a livello dei villi e della tonaca propria) e per il quadro clinico.
Nella sindrome da immunodeficienza si può osservare un’atrofia subtotale dei villi ma, a differenza della M.C., si osserva una marcata diminuzione o assenza nella lamina propria di plasmacellule.
Nella sprue tropicale la storia clinica, o frequenti viaggi o residenza nelle aree endemiche possono essere di aiuto nella diagnosi; le alterazioni istopatologiche sono simili a quelle della M.C. ma con criteri di minore gravità, l’unico dato caratteristico è normalmente rappresentato da una distribuzione più distale delle lesioni che tendono ad essere più evidenti a livello ileale senza una correlazione diretta tra quadro clinico e morfologico.
Anche il linfoma intestinale si presenta con una storia di malassorbimento, alla biopsia del piccolo intestino si osserva l’atrofia secondaria dei villi ma con una associata atrofia delle cripte. Le lesioni istologiche e la sintomatologia clinica non si modificano con la dieta priva di glutine.
Nella gastroenterite eosinofila la diagnosi differenziale può essere effettuata sulla presenza di una spiccata eosinofilia periferica e attraverso la biopsia intestinale che mette in evidenza una irregolarità dei villi (appiattiti, bifidi e tozzi) con un massiccio infiltrato linfocitario, plasmacellulare ed eosinofilo che interessa tutta la tonaca mucosa.
Nelle malattie parassitarie quali la strongiloidiasi e la giardiasi può essere presente un quadro di malassorbimento con modificazioni della morfologia digiunale che raramente raggiungono l’atrofia totale; l’esame parassitologico delle feci ci permette di distinguere le due parassitosi dalla M.C..
CASISTICA PERSONALE
Dal 1988 al 1999 abbiamo diagnosticato, in collaborazione con l’Ospedale S. Eugenio-Roma, 252 adulti celiaci
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 12 di 18 (74 uomini e 178 donne, età media 27,9 anni con un range di 15-65 anni, F/M 2,4).
144 pazienti riferivano sintomi gastrointestinali quali diarrea, dolori addominali, flautolenza, rallentato svuotamento gastrico, accompagnati da un calo ponderale; mentre 108 soggetti presentavano esclusivamente sintomi extraintestinali o erano affetti da M.C. silente. In tutti i pazienti sono stati misurati i livelli sierici di IgA (v.n.90-450mg/dl) al fine di escludere una condizione di deficit selettivo di IgA. Tutti i pazienti hanno eseguito il dosaggio degli AGA IgA-IgG (v.n.IgA>0,2EU/ml; IgG >10.0 EU/ml) (elisa-alfa Gliatest, Eurospital, Trieste-Italia), degli anticorpi antiendomisio con immunofluorescenza su esofago di scimmia (Antiendomisium-Eurospital-Trieste, Italia) e biopsie della seconda porzione duodenale.
I pazienti sono stati divisi in 3 gruppi: 1°gruppo- M.C. classica in cui la presenza di un’enteropatia da glutine era accompagnata da sintomi gastrointestinali quali diarrea, vomito, dolori addominali e/o epigastrici; 2°gruppo- una forma subclinica in cui al danno intestinale si associavano solo sintomi extraintestinali; 3° gruppo- una forma silente che, in presenza di un danno intestinale, non si accompagnava a nessun tipo di sintomo. Gli appartenenti a questo ultimo gruppo sono stati identificati nel corso di screening di soggetti ad alto rischio di M.C. quali parenti, pazienti affetti da diabete mellito insulino-dipendente, Sindrome di Down, deficit di IgA, disordini tiroidei, aumento inspiegato di transaminasi ecc…
RISULTATI
Nella nostra casistica la M.C. si è presentata nella forma classica in 144 pazienti (57,14%) mentre 108 pazienti avevano una forma subclinica/silente (42,86%). Considerando esclusivamente i 108 pazienti con la forma subclinica/silente, 88 pazieneti (34,92%) avevano una forma subclinica mentre 20 pazienti (7,94%) si sono presentati con una forma silente.
Le manifestazioni cliniche o disordini associati riscontrati più frequentemente nel gruppo di pazienti con M.C. subclinica/silente sono stati: l’anemia sideropenica 27,77%, l’alopecia 12,50%, la dermatite erpetiforme 11,36%, l’osteopenia 6,81%, la stomatite aftosa 5,68%, l’amenorrea e gli aborti ricorrenti 4,54%, altri (calcificazioni cerebrali, depressione, epilessia, bassa statura ecc…) 3,4%. Nel gruppo con M.C. silente il 30% dei pz. era rappresentato da parenti di 1°grado, il 25% avevano il Morbo di Basedow ed il 20% il diabete mellito insulino dipendente (Tabella 1).
Le più frequenti manifestazioni extraintestinali riscontrate nei pazienti con M.C. classica sono state l’anemia sideropenica 32,3%, la depressione 25%, la dermatite erpetiforme 24,9%, la stomatite aftosa 24,9%, l’osteoporosi 17%, l’alopecia 14,8% (Tabella 2). La sintomatologia intestinale relativa alla forma classica riscontrata nei nostri pazienti era composta da diarrea 58%, dolori addominali e meteorismo 22,79%, vomito e dispepsia. La presenza dell’Helicobacter pylori (H.P.) in tutti i pazienti osservati è risultata inferiore rispetto alla popolazione normale, l’eradicazione dell’H.P. in assenza di dieta senza glutine non modificava i sintomi dispeptici.
Dal 1988 al 1999 la prevalenza di nuovi casi di M.C. è diminuita notevolmente mentre sono aumentate le diagnosi delle forme subcliniche/silente. Infatti nel 1988 il 100% dei pazienti avevano una forma classica, nel 1999 invece il 71,87% delle forme diagnosticate riguardavano la M.C. subclinica/silente mentre la forma classica è stata diagnosticata nel 28% dei soggetti.
CONCLUSIONI
Negli ultimi anni si è osservato un aumento della diagnosi di M.C. specialmente delle forme atipiche, paucisintomatiche e silenti. Infatti circa 1/3 dei nostri pazienti diagnosticati dal 1988 al 1999 hanno manifestato solo una modesta sintomatologia quale un rallentato svuotamento gastrico.
Osservando la Figura 1 possiamo notare che nei 12 anni di osservazione la
prevalenza della forma classica è diminuita, mentre sono aumentate le forme subcliniche e silenti. Questo è probabilmente correlato non solo ad una migliore e precoce diagnosi da parte dei gastroenterologi ma anche ad una maggiore sensibilizzazione degli altri specialisti.
Il nostro studio mette in evidenza che la forma subclinica/silente è associata ad una grande varietà di sintomi e patologie extraintestinali. In particolare l’anemia sideropenica è il più frequente marcatore della forma subclinica.
Il nostro lavoro conferma inoltre l’associazione tra alcune patologie extraintestinali e la malattia celiaca quali
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 13 di 18 l l
l
l
First-degree Relatives
6 (30%)
Hyperthyroidism
5 (25%)
Insulin-dependent Diabetes
4 (20%)
Hypothyroidism
2 (10%)
IgA Deficiency
1 (5%)
Down’s Disease
1 (5%)
Loss of Kerkring folds at endoscopy
1 (5%)
Total
20 (100%)
Iron-deficiency anemia
24 (27.27%)
Alopecia
10 (11.36%)
Dermatitis Herpetiformis
10 (11.36%)
Osteoporosis
6 (6.81%)
Recurrent Aphtous Stomatitis
Amenorrhea/Recurrent Abortion
5 (5.68%)
4 (4.54%)
Short Stature
3 (3.40%)
Epilepsy/Cerebral Calcifications
3 (3.40%)
Depression
3 (3.40%)
Dental Enamel Hypoplasia
2 (2.27%)
Onycodystrophy
2 (2.27%)
Recurrent Phractures
2 (2.27%)
Hypertransaminasaemia
2 (2.27%)
Ulcerative Colitis
2 (2.17%)
Crohn’s Disease
1 (1.13%)
Atopy
1 (1.13%)
Erithema Nodosus
1 (1.13%)
Lupus Erithematosus Sistemicus
1 (1.13%)
‘epilessia, le calcificazioni cerebrali, l’alopecia, l’ipoplasia dentaria, l’atopia, l’osteoporosi,
‘ipertransaminasemia, l’amenorrea e aborti ricorrenti, malattie infiammatorie croniche, disordini tiroidei. I nostri risultati sono simili a quelli descritti in due recenti studi, uno Italiano e l’altro nord Americano, che mostrano l’ampio range di sintomi e/o disordini associati alla M.C. Per esempio l’anemia sideropenica può essere giustificata da un ridotto assorbimento di ferro da parte della mucosa duodenale e da tratto prossimale dell’intestino tenue. Una associata contaminazione batterica dell’intestino tenue in pazienti non trattati può ridurre la quantità delle vitamine e dei minerali (Zn o Ca) e giustificare disordini associati quali l’osteoporosi e
a stomatite aftosa.
Al momento non conosciamo la correlazione che esiste tra alcune patologie extraintestinali quali il LES o la mucoviscidosi, in questi casi non possiamo escludere una coincidenza occasionale.
I dati in nostro possesso confermano l’estremo polimorfismo di questa malattia che può colpire moltissimi organi o apparati.
A nostro avviso, con le attuali conoscenze, riusciamo solo ad osservare la parte emersa di quell’iceberg che è a malattia celiaca con le sue forme cliniche; solo con un accurato screening sulla popolazione ed il miglioramento dei mezzi diagnostici a nostra disposizione riusciremo a descrivere e comprendere tutte le
manifestazioni della malattia.
TABLE 1. SILENT COELIAC DISEASE DIAGNOSED DURING SCREENING PROGRAM (NO.[%])
TABLE 2. FREQUENCY OF EXTRAINTESTINAL DISORDERS AND ASSOCIATED DISEASES IN SUBJECTS WITH SUBCLINICAL COELIAC DISEASE (NO.[%])
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 14 di 18 Mucoviscidosis
Idrarto
Addison’s Disease
Myositis
Psoriasis
Long QT Interval
Total
1 (1.13%)
1 (1.13%)
1 (1.13%)
1 (1.13%)
1 (1.13%)
1 (1.13%)
88 (100%)
Giovanni Brandimarte
Divisione di Medicina Interna, Servizio di Endoscopia Digestiva Ospedale Cristo Re, Roma
Antonio Tursi
Divisione di Medicina Interna, Ospedale L.Bonomo, Andria
Gian Marco Giorgetti
U.O. Nutrizione Clinica, Ospedale S.Eugenio, Roma
Elena Rubino
Divisione di Medicina – Ospedale “Cristo Re” Roma
La malattia celiaca nell’anziano
INTRODUZIONE
La Malattia celiaca (MC) può essere definita come “un’enteropatia cronica con lesioni caratteristiche, ma non strettamente specifiche, dell’intestino tenue che, nel tratto coinvolto, impediscono l’assorbimento dei nutrienti e che migliorano, fino a poter scomparire, eliminando dalla dieta la gliadina del frumento e le prolamine dell’orzo, della segale e dell’avena.”
Il malassorbimento sembra essere quindi legato all’estensione delle lesioni intestinali e ciò potrebbe giustificare, almeno sotto alcuni aspetti, l’eterogeneità clinica della MC, che può presentarsi con forme carenziali gravi, ma anche decorrere per molti anni oligosintomatica o addirittura asintomatica.
Per tale motivo questa malattia può essere diagnosticata non nell’infanzia, ma anche in età adulta, quando si verificheranno condizioni (abitudinarie, ambientali, occasionali ecc…) tali da indurre la comparsa di sintomi che sollecitano l’esecuzione di test specifici per il suo riconoscimento. In particolare, sono in aumento le diagnosi di MC nei pazienti adulti che hanno una sintomatologia atipica, e questo anche grazie alla disponibilità di test di screening sensibili e specifici ed alle maggiori conoscenze aquisite nelle presentazioni cliniche della malattia.
Gli studi epidemiologici presenti in letteratura riportano dati di prevalenza estremamente variabili, anche se negli ultimi anni molti Lavori hanno riportato valori che si attestano intorno a 1:250-1:300.
I motivi delle diagnosi eseguite attraverso la sintomatologia sono cambiati nel tempo. Nei casi raccolti dal gruppo di Gasbarrini tra il ’70 ed il ’90 si è assistito, per esempio,ad una diminuzione in percentuale della “diarrea” che negli anni ’72-’77 rappresentava il 90.9% delle modalità di presentazione della M.C. nell’adulto, fino al 54,6% nel periodo ’84-’89. I sintomi “classici” (diarrea, malassorbimento con calo ponderale, meteorismo, dolori addominali) lasciano il posto a segni considerati “atipici”: nella stessa casistica, il 4,5% dei pazienti diagnosticati nel periodo ’72-’77 presentava clubbing ungueale e stomatite aftosa, mentre nel periodo ’84-’89 tali manifestazioni sono state identificate rispettivamente nel 39,7% e nel 19,1% dei casi diagnosticati.
Gli autori Bibliografia
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 15 di 18 In età geriatrica la M.C. si ritiene possa presentarsi con le stesse caratteristiche della malattia dell’adulto, e la frequenza riportata in letteratura varia dal 4 al 25%.
In realtà poche sono le casistiche che hanno studiato un’ampia popolazione veramente anziana: in uno studio condotto da Kirby e Fielding nel 1994, sono stati presi in considerazione 18 pazienti oltre i quarant’anni: di questi solo 3 avevano più di sessanta anni! Hankey e Holmes hanno analizzato 42 pazienti con diagnosi di M.C. effettuata oltre i sessant’anni, ma in questa casistica la sintomatologia clinica dei pazienti avrebbe potuto condurre ad una corretta diagnosi molto tempo prima: 7 pazienti avevano infatti già manifestato la Dermatite erpetiforme (in un caso 34 anni prima) e 6 pazienti, precedentemente diagnosticati come affetti da colite o da intestino irritabile, lamentavano una sintomatologia gastrointestinale da almeno 9 anni.
SCOPO DELLO STUDIO Scopo del nostro lavoro è stato quello di identificare le principali caratteristiche cliniche e di presentazione dei celiaci diagnosticati nella maggior parte dei Centri italiani a cui può afferire la patologia celiaca non pediatrica.
Ciò allo scopo di cercare di avere informazioni sui seguenti punti:
verificare la reale frequenza della MC in una popolazione ” anziana”
studiare le modalità di presentazione – cliniche e laboratoristiche – della MC per fornire indicazioni al gastroerologo e al medico di medicina generale che possano favorirne la diagnosi
chiarire se è possibile che la MC possa avere un’epoca di esordio in età geriatrica.
PAZIENTI E METODI
A tutti i Centri di Medicina Interna e di Gastroenterologia italiani, a cui, abitualmente, afferiscono in prevalenza i malati con patologia intestinale, e maggiormente dedicati allo studio della MC, indicati come “di riferimento” e facenti parte del “Club del Tenue”, è stato inviato un questionario volto a scoprire il numero di diagnosi di MC effettuate in età geriatrica. Considerando età geriatrica quella maggiore di 65 anni, sono stati presi in considerazione i casi diagnosticati e controllati almeno due volte da ciascun Centro.
In questi casi sono state analizzate, in particolare, le modalità di presentazione clinica della celiachia, le principali alterazioni laboratoristiche, le patologie associate, le complicanze e le più frequenti cause di decesso.
RISULTATI
Nove centri di gastroenterologia hanno aderito allo studio.
1.353 pazienti celiaci sono stati diagnosticati complessivamente dai Centri partecipanti.
Pazienti (M=16; F=44; M/F= 1:2,8) sono stati diagnosticati in età geriatrica (4.4%), 1293 (M=378;
F=915; M/F=1:2,4) in età adulta.
Fra gli anziani, 46/60 pazienti (76,6%) presentavano diarrea al momento della diagnosi (Tab 1).
In 35/60 pazienti (58.3%) era presente anemia sideropenica e in 14/60 (23,3%), 12 dei quali di sesso femminile, era presente ipoalbuminemia (Tab 2)
Nel 41,6% dei casi (25 pazienti, 21 dei quali di sesso femminile) era presente osteoporosi.
Solo 3 pazienti su 60 erano completamente asintomatici (5%).
In 4/60 non vi è stata risposta alla dieta aglutinata, contro 19/1293 pazienti diagnosticati in età adulta.
Sette pazienti su 60 (11.6%) hanno rifiutato la dieta priva di glutine o hanno avuto una scarsa “compliance” ad essa. Nella popolazione adulta il 20% dei pazienti mostrava scarsa “compliance”.
La complicanza più frequente è rappresentata dai linfomi, presenti in 5/60 pazienti (8.3%) (Tab.3).
Il linfoma è risultato, inoltre, la causa di morte più frequente nella popolazione celiaca studiata, sia adulta che, soprattutto, anziana: il 8,3% degli anziani e lo 0,5% degli adulti sono deceduti per tale malattia. (Tab.4 Tab. 5).
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 16 di 18 Le patologie più frequentemente associate negli anziani sono risultate essere: epatite cronica in 8 casi, diabete mellito in 4 casi, dermopatie in 3 casi. (Tab.6)
In 18/45 (40%) soggetti di cui si disponevano dati circa l’età di esordio della malattia è stato possibile stabilire che l’epoca di esordio dei sintomi è iniziata oltre l’età geriatrica.
CONCLUSIONI
La Malattia Celiaca (MC) è una enteropatia caratterizzata da alterazioni istologiche caratteristiche sebbene non specifiche, ma da manifestazioni cliniche estremamente variabili, motivo per cui per molti anni è stata erroneamente ritenuta una patologia di esclusiva pertinenza dell’infanzia, nella quale i segni di malassorbimento quali la diarrea, la steatorrea, la perdita di peso e la malnutrizione severa avevano indotto la diagnosi.
A partire dagli anni ’70, parallelamente alla descrizione di forme cliniche di MC diverse da quelle classiche di malassorbimento, grazie all’introduzione di test di screening relativamente semplici e sensibili, eseguiti, ad esempio, nei familiari di pazienti affetti da MC si è assistito non solo ad un aumento del numero totale di biopsie duodenali endoscopiche e quindi di diagnosi, ma soprattutto ad un’innalzamento dell’età di diagnosi; da allora si è iniziato a parlare di MC dell’adulto. Anche l’accertamento di un tipico aspetto endoscopico nel duodeno come l’alterazione delle pliche di Kerkring, caratteristico della MC, ha indotto alla esecuzione di un maggior numero di biopsie duodenali rivelatesi diagnostiche.
Rivedendo le diagnosi effettuate nella nostra casistica (dei Centri di Bologna e di Roma) a partire dal 1972 fino alla fine degli anni ’80, abbiamo notato che, soprattutto dall’inizio di quest’ultima decade, c’è stato un aumento notevole delle diagnosi di MC in età adulta ed in particolare di quelle forme cliniche meno “gravi”, che in passato rimanevano sicuramente misconosciute. Se, infatti, negli anni ’70 il 90% dei pazienti veniva diagnosticato in base alla diarrea e perdita di peso, e, ad esempio, l’ippocratismo digitale era un segno poco rappresentato, descritto solo nel 4,5% di tutti i pazienti, nel periodo ’84-’89 solo il 50% dei casi di MC presentava diarrea e perdita di peso, mentre ben il 40% manifestava clubbing ungueale.
E’ logico pensare che, se solo negli ultimi anni si è iniziato a diagnosticare la celiachia nell’adulto, molti celiaci non diagnosticati perchè sfuggiti alla diagnosi in età pediatrica o perchè oligosintomatici, a meno che non siano deceduti nel frattempo, dovrebbero, a questo punto, aver raggiunto l’età senile. Alcuni lavori hanno riportato nelle loro casistiche una percentuale di diagnosi oltre i 60 anni variabile dal 4 al 25%, con manifestazioni cliniche sostanzialmente sovrapponibili a quelle descritte nell’adulto, e questo, se da un lato riflette la maggiore attenzione da parte dei medici verso forme cliniche meno palesi clinicamente, dall’altro potrebbe denunciare una certa disattenzione da parte dei colleghi che li hanno preceduti, probabilmente tanto maggiore quanto più alto risulta essere il numero di diagnosi effettuate in età senile (6,7%). In un lavoro pubblicato nel 1994 su Gut, il 16 % dei pazienti aveva la dermatite erpetiforme ed uno di questi pazienti ha avuto la diagnosi di MC dopo 34 anni di malattia dermatologica manifesta. Il 35,7% aveva una storia di anemia variabile da 0 a 50 anni.
E’ possibile però che in alcuni pazienti i sintomi clinici non si manifestino nell’infanzia o in età adulta, e che quindi la diagnosi non sia fatta in ritardo ma solo quando la malattia si è resa clinicamente manifesta. Questo non è certamente il caso della casistica riportata da Hankey e Holmes, ma potrebbe riflettere quanto è successo nella popolazione studiata dal nostro gruppo. Nella nostra popolazione anziana la maggior parte delle diagnosi sono state effettuate sulla base di sintomi clinici per nulla “atipici”: nel 76% dei casi era presente infatti diarrea, nel 60% perdita di peso e nel 23% ipoalbuminemia, mentre solo il 5% era completamente asintomatico al momento della diagnosi. E’ difficile pensare che tali sintomi sarebbero potuti rimanere per tanti anni male interpretati, soprattutto se si confrontano con quelli descritti in precedenza in un nostro lavoro sulla popolazione adulta: in quella casistica, nella popolazione diagnosticata tra il 1984 ed il 1989 solo il 54% dei pazienti manifestava diarrea, il 55% perdita di peso e il 23% ipoalbuminemia.
Nella nostra casistica il rapporto maschio femmina tra i pazienti geriatrici è sovrapponibile a quello tra gli adulti (1:2,8 tra i geriatrici e 1:2,4 negli adulti).
Nel 7% dei pazienti geriatrici diagnosticati non vi è stata risposta alla dieta aglutinata. Una così alta percentuale di non responders potrebbe essere spiegata con una più lunga durata di esposizione al glutine da parte di questi pazienti.
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 17 di 18 copyright © 2002 – 2017 QBGROUP spa
Sarà importante controllare nel tempo questo gruppo di pazienti, che potrebbero essere più a rischio di sviluppare complicanze come il linfoma.
Questa è infatti la complicanza più frequente nella popolazione geriatrica da noi indagata, presente nel 8,3% dei pazienti studiati; il linfoma è risultato essere, inoltre, la causa di morte più frequente negli stessi pazienti: il 3,5% sono deceduti per tale causa, mentre nella popolazione adulta il linfoma è stato responsabile della morte dello 0,5% dei pazienti. Una percentuale così alta di linfomi in una popolazione celiaca geriatrica è quanto ci saremmo potuti aspettare: secondo alcuni Autori infatti il linfoma del piccolo intestino è più frequente in quei casi in cui la malattia celiaca si manifesta tardivamente.
Questo è in contrasto con l’opinione di Altri, secondo i quali il linfoma sarebbe più rappresentato nei celiaci con una lunga durata di malattia; i nostri pazienti non hanno avuto una lunga durata di malattia (clinicamente manifesta), ma non possiamo escludere che non possano avere avuto una lunga latenza, o addirittura una lunga durata di malattia silente. Si ipotizza che il linfoma sia più frequente nei pazienti che “sono” celiaci, ed i pazienti nei quali la malattia si è manifestata più tardivamente sono celiaci che hanno avuto una più lunga esposizione al glutine rispetto a quelli con esordio clinico più precoce.
Italo De Vitis
Istituto di Medicina Interna e Geriatria Università Cattolica del Sacro Cuore, Roma
Gasbarrini
Istituto di Medicina Interna, Policlinico “A. Gemelli” Università Cattolica del Sacro Cuore – Roma
http://www.gastronet.it/scientifico/approfondimento/celiachia/cap1/default.html 12/04/17, 17=20 Pagina 18 di 18