
Dott.ssa Daniela PELOTTI
La corretta alimentazione

Pubblicato inArticoli scientifici
Il Glutine Danneggia I Reni
Il Glutine Danneggia I Reni Il Glutine Causa Malattie Renali? La malattia renale è un aspetto trascurato da molti pazienti con intolleranza al glutine. In questo recente studio, la perdita di proteine si è dissipata con una dieta priva di…

Pubblicato inArticoli scientifici
Ansia attacchi di panico indicano patologie del cuore
Gli stati di ansia a volte senza motivo reale indicano che vi è uno stato…
Pubblicato inArticoli scientifici
SUICIDIO
Alterazioni molecolari presenti nel tessuto cerebrale e nel sangue di persone che si sono suicidate…
Pubblicato inArticoli scientifici
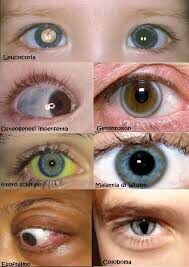
Alcune malattie ereditarie degli occhi possono essere scatenate dai batteri intestinali
La ricerca suggerisce che le malattie degli occhi a lungo ritenute puramente genetiche potrebbero essere causate in…

Pubblicato inArticoli scientifici
NEUROMIELITE OTTICA
Neuromielite ottica in pazienti con sensibilità al glutine associata ad anticorpi contro l’acquaporina-4 S Giario , S.…
Pubblicato inArticoli scientifici
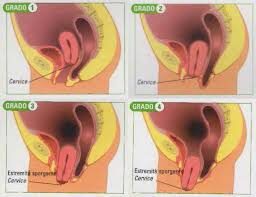
PROLASSO UROGINECOLOGICO
Effetti dell’obesità sugli esiti della chirurgia del prolasso uroginecologico Una revisione sistematica e una meta-analisi Ringel, Nancy E. MD, MS; Lenger, Stacy M. MD; Alto, Rachel MD; Ahimè, Alexandria MD; Houlihan, Sara MD; Chang, Olivia H. MD, MPH; Pennycuff, Jon MD; Singh, medico Ruchira; Bianco, MD Amanda; Lipitskaia, Lioudmila…

Pubblicato inArticoli scientifici
MORTE IN CULLA SIDS
Sindrome della morte improvvisa del lattante (SIDS) Il mio suggerimento nel rilevare il rischio di…

Pubblicato inArticoli scientifici
SINDROME DELL’X FRAGILE
Il nome sindrome dell’X fragile deriva dal fatto che il cromosoma X appare rotto o…
Pubblicato inArticoli scientifici
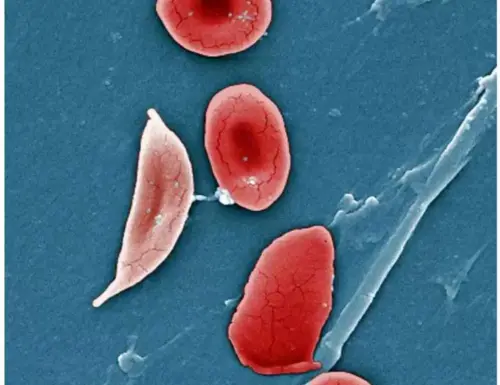
Anemia falciforme
Celiac.com 31/05/2019 (pubblicato originariamente il 08/10/2010) – Ciao. Il mio nome è Gerald Cooper. A mia moglie…

Pubblicato inArticoli scientifici
Testimonianza di Gravidanza dopo diversi tentativi falliti
2-09-19 Salve dottoressa sono XXXXXci siamo sentite telefonicamente e su wathsapp due mesi fa ……